
--哪些因素影响了你的溶出结果?
--好的溶出方法应具有区分力,好的溶出仪应该具有哪些素质呢?

溶出技术在口服固体制剂等剂型中至关重要,是制剂工业核心分析技术之一。近些年,国内仿制药一致性评价的推动,以及无数行业专家等的呐喊和呼吁,让无数制药同行认识到溶出技术的重要性。很多指导原则(部分尚处于征求意见阶段)中也对药物的溶出有着各种各样的规定(如下仅列举部分,部分或有更新或不适用):
--《中国药典》0931溶出度与释放度测定法,以及药典各具体产品中溶出规定;--现行版《M4:人用药物注册申请通用技术文档(CTD)》;
--国家药监局药审中心关于发布《已上市化学药品药学变更研究技术指导原则(试行)》的通告(2021年第15号);
--国家药监局药审中心关于公开征求《〈已上市化学药品药学变更研究技术指导原则(试行)〉中溶出曲线研究条件的问答(征求意见稿)》意见的通知;
--总局关于发布化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)的通告(2016年第120号);
--总局关于发布药物溶出度仪机械验证指导原则的通告(2016年第78号);
--国家食品药品监督管理总局关于发布普通口服固体制剂溶出度试验技术指导原则和化学药物(原料药和制剂)稳定性研究技术指导原则的通告(2015年第3号);
溶出技术在制剂工业中的应用主要体现在2个方面,第一个是用来指导药品的开发,第二个用于产品获批后(含变更)等的质量控制。
一个好的溶出方法应该具有区分力。王亚敏在《浅谈溶出度检查方法的分辨力》中提到,溶出度检查方法的分辨力是指方法可以发现和区分制剂质量变化的能力。一个有效的溶出度检查方法应当能够发现可能影响制剂的生物药剂学行为的处方、生产工艺等方面的变化。
如何进行溶出方法的开发,我们这里不做详述。感兴趣的可以参考下面2篇文章:
除了溶出条件外,溶出仪则是影响溶出结果的另外一个重要因素。
一个好的溶出仪,应该具有哪些素质呢?小编认为,主要有如下3个方面:
首先,应该有好的硬件条件,好的硬件是产品后续性能的基本保障。
溶出度仪水平度、篮(桨)轴垂直度、溶出杯垂直度、溶出杯与篮(桨)轴同轴度、篮(桨)轴摆动、篮摆动、篮(桨)深度、篮(桨)轴转速、溶出杯内温度等溶出仪性能参数对药物的溶出速率有着显著的影响。注射器等则影响取样量。

溶出仪的硬件是保证上述性能的基础,也是影响溶出仪使用周期的重要因素,以深圳华溶某型号溶出仪为例,核心配件选择优良供应商。
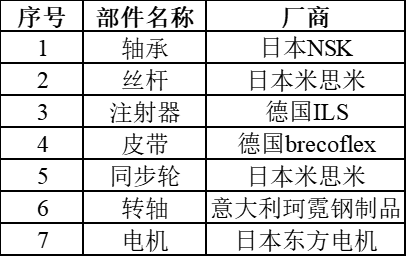
有了优良的配件供应商保障,为后续产品性能打下很好的基础。
其次,良好的机械验证。
2016年4月总局发文,为保证体外溶出试验数据的准确性和重现性,所使用的溶出度仪应满足《中国药典》要求,同时还需满足《药物溶出度仪机械验证指导原则》规定的各项技术要求。
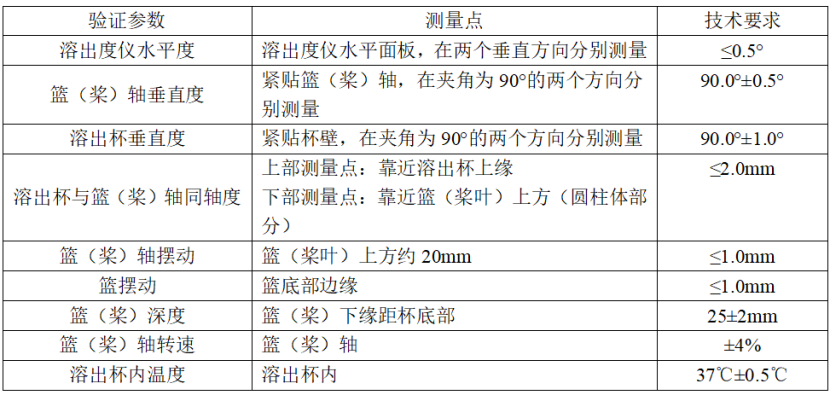
溶出度仪机械验证应满足如下要求:
溶出度仪机械验证参数列表
再来看看深圳华溶仪器某型号溶出仪机械验证结果:

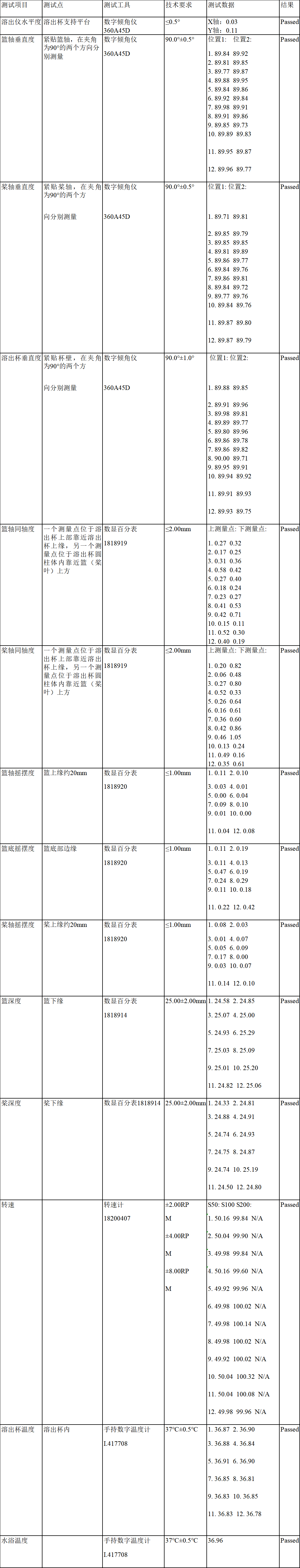
验证各项目,均能符合指导原则要求。
最后,素质体现在实际溶出应用中。
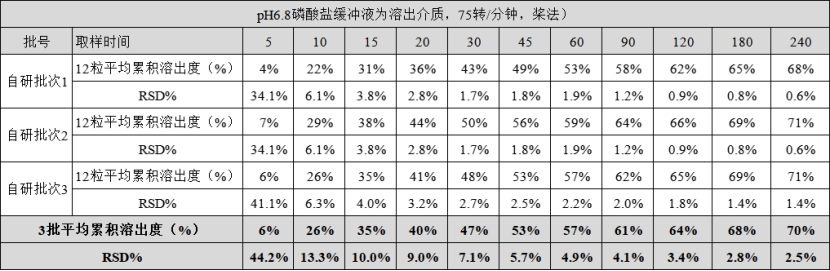
我们以安士制药仿制药熊去氧胆酸胶囊为例看看溶出仪的应用情况(备注:溶出仪是必要非充分条件哦,还需要产品有合适的处方工艺,以及匹配的溶出条件等)。
如下为熊去氧胆酸胶囊在pH6.8磷酸缓冲液,75转/分钟,桨法条件的溶出数据。客户检测了参比制剂3批,自研批次3批,每个批次均为12单位制剂,取样时间点为11个。分别比较了批内差异、批间差异。数据可见,产品批内以及批间差异小。
合适的处方工艺、匹配的溶出条件、配上高素质的溶出仪,该客户BE顺利通过,并首仿获批。
熊去氧胆酸胶囊3批自研批次在pH6.8磷酸缓冲液中的溶出(75转/分钟,桨法)
熊去氧胆酸胶囊3批参比批次在pH6.8磷酸缓冲液中的溶出(75转/分钟,桨法)
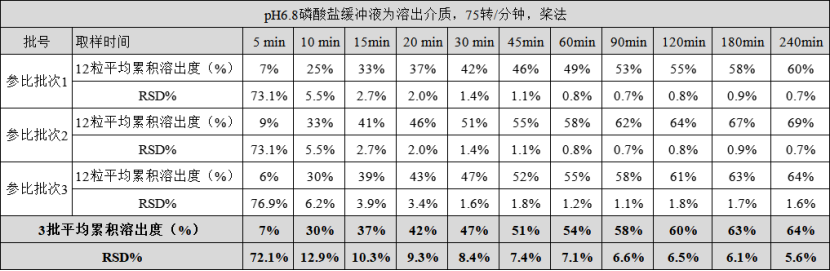
熊去氧胆酸胶囊3批自研产品和参比批次溶出曲线对比(pH6.8,桨法75转/分钟)
总 结
制剂开发是一项系统工程,涉及到多个学科部门,而溶出技术是制剂工业核心分析技术之一。好的溶出方法能够指导药物开发,能够发现和区分制剂质量变化。工欲善其事,必先利其器。一台好的溶出仪则是药物研发人员的好武器。
深圳华溶仪器,走自主创新之路,经过几年的奋战研发出了“质量过硬,性价比高”的各类产品,包含流池法溶出仪,桨篮法溶出度仪,往复筒溶出仪,透皮扩散系统等,拥有30多项专利,成为国内首家将活塞泵流池法溶出仪系统商品化的行业先行者。高质量的配件、良好的机械验证、结合客户实际应用案例,很好的诠释了一台优秀的溶出仪。(《溶出仪国产之光:深圳华溶仪器的破局之路》)
部分参考文献:
--王亚敏,浅谈溶出度检查方法的分辨力,药物分析杂志2012,32(11),2094-2096
--国家药监局药审中心关于发布《已上市化学药品药学变更研究技术指导原则(试行)》的通告(2021年第15号)https://www.cde.org.cn/main/news/viewInfoCommon/4ec3dca752a82347bdf24ad3d3e85113
--关于公开征求《〈已上市化学药品药学变更研究技术指导原则(试行)〉中溶出曲线研究条件的问答(征求意见稿)》意见的通知https://www.cde.org.cn/main/news/viewInfoCommon/2d74cd1047b101e80b3576c869e7d01e
--总局关于发布化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)的通告(2016年第120号)https://www.cde.org.cn/yzxpj/news/viewInfoCommon/8e155d95b425086505186ba7483de0e8
--总局关于发布药物溶出度仪机械验证指导原则的通告(2016年第78号) https://www.nmpa.gov.cn/zhuanti/ypqxgg/ggzhcfg/20160429160201218.html
<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论