近日,上海阳光医药采购网发布了众生睿创的新冠治疗药品来瑞特韦片(商品名:乐睿灵)首发报价公告,公示乐睿灵的首发价格为628元/盒/疗程(规格包装:200mg/片,包装单位:10片/板,3板/袋,1袋/盒)。公示信息显示,来瑞特韦片的含税出厂价格为584-597元,原料药成本为306.17元,直接研发费用约5.92亿元。
来瑞特韦片(RAY1216)是广谱抗新冠病毒3CL蛋白酶抑制剂,通过作用于新型冠状病毒主蛋白酶(mainprotease,Mpro,3CLpro),抑制病毒前体蛋白质的切割,进而阻断病毒复制,达到抗新冠病毒的作用。
来瑞特韦片基本信息(部分)
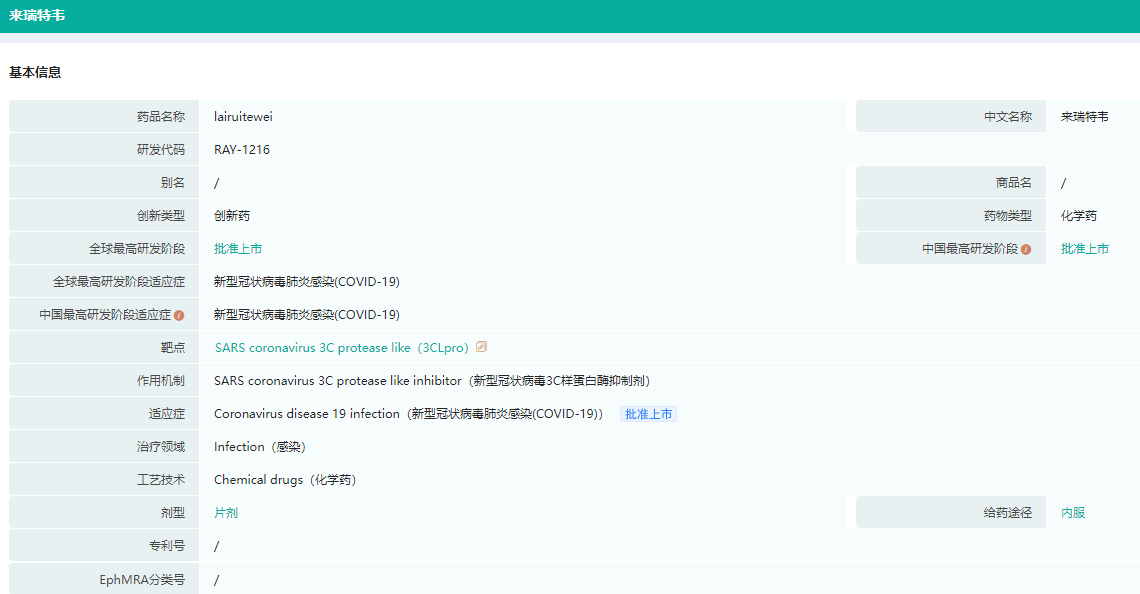
图片来源:药融云全球药物研发数据库
来瑞特韦片在野生株、阿尔法、贝塔、德尔塔、奥密克戎(包括BA.5、BF.7)等多种新冠病毒感染的细胞模型中,可以有效抑制新冠病毒复制,展现了广谱抗新冠病毒的能力。
一、6款新冠治疗药品,阿兹夫定片价格最低
药融云数据库显示,目前在国内上市的国产新冠治疗药物有4款,真实生物的阿兹夫定片、先声药业的先诺特韦/利托那韦、君实生物/旺山旺水的氢溴酸氘瑞米德韦片、以及众生睿创的来瑞特韦片。此外,还有2款国外进口的小分子药物,辉瑞的Paxlovid(简称P药),以及默沙东的莫诺拉韦胶囊(简称M药)《新冠第二波感染潮或将来袭!5款新冠口服药和12款疫苗如何选择?》。
阿兹夫定研发历程时间轴(部分)
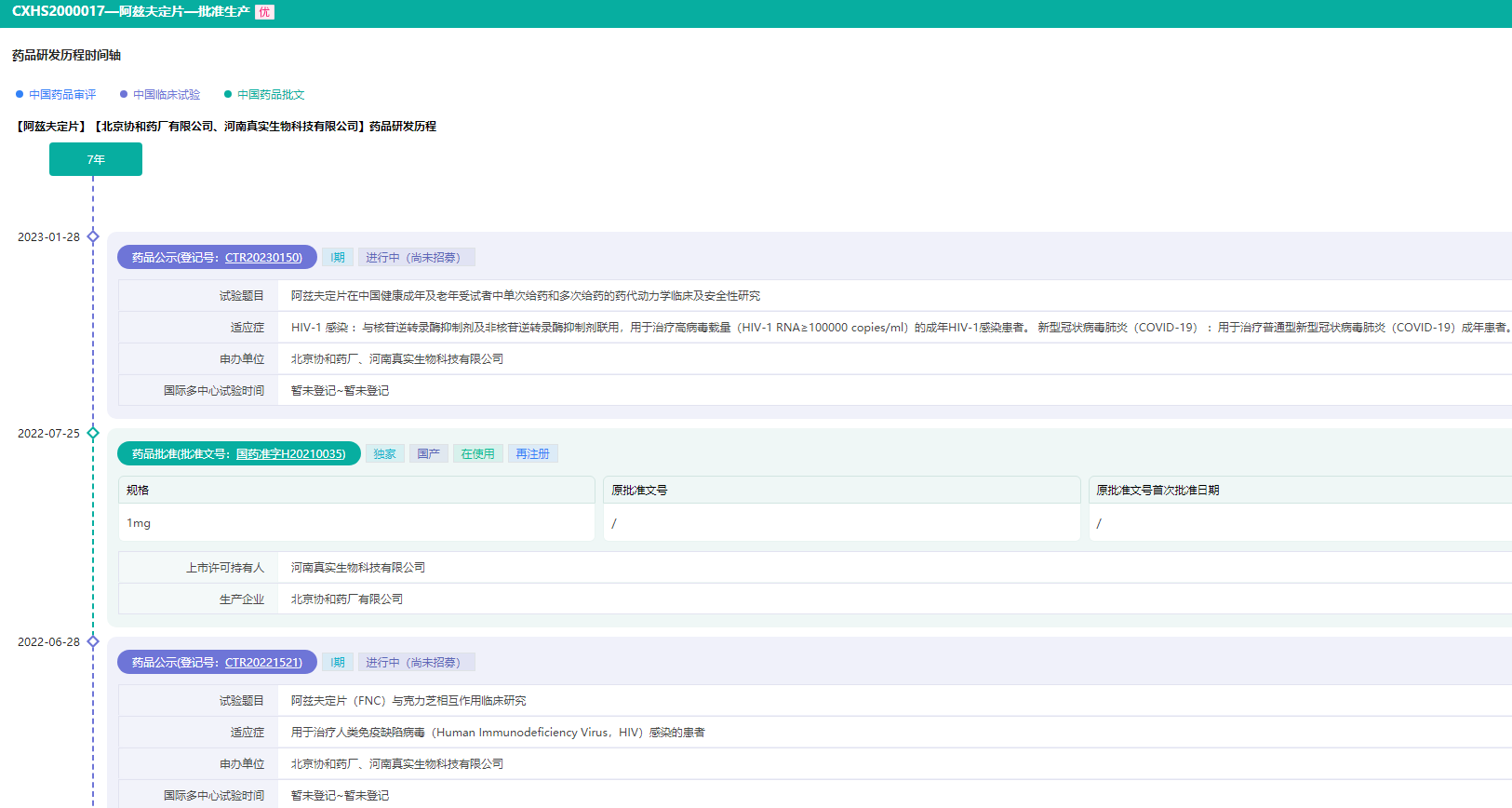
图片来源:药融云中国药品审评数据库
此前,其他企业也曾公示了各自研发的新冠治疗药品首发报价。其中,辉瑞的奈玛特韦片/利托那韦片(商品名:Paxlovid)为1890元/疗程;默沙东的莫诺拉韦胶囊(商品名:利卓瑞)为1500元/疗程;旺实生物的氢溴酸氘瑞米德韦片(商品名:民得维)为795元/疗程;先声药业的先诺特韦/利托那韦组合包装(商品名称:先诺欣)为750元/疗程;真实生物的阿兹夫定片平均445元/疗程(医保前540元,医保后350元)。
目前,获批上市的国产新冠治疗用药已全部被纳入医保支付范围。药融云医保目录数据库显示,中药「三药三方」和阿兹夫定片已正式纳入医保药品目录;氢溴酸氘瑞米德韦片、先诺特韦片/利托那韦片组合包装等药品临时性纳入医保支付范围,在2023年3月31日前可享受到相关的医保报销政策。
国家医保(2022年版)品种查询
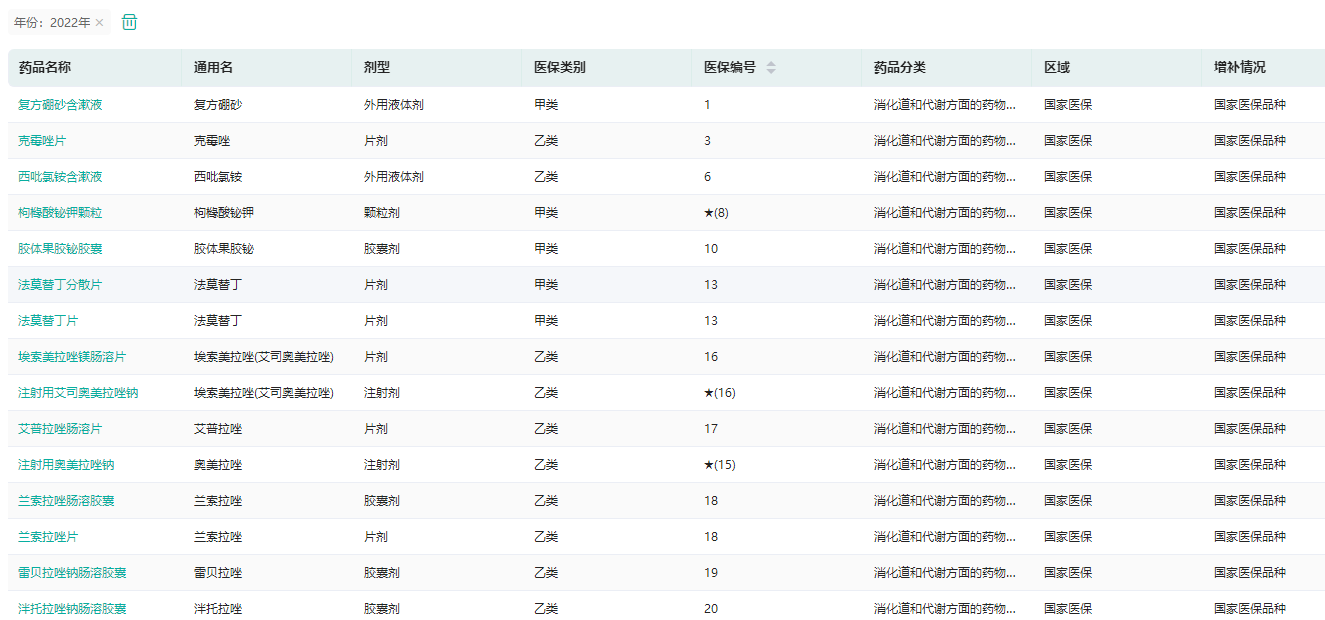
图片来源:药融云医保目录数据库
二、4月起新冠药品分为三类管理,A类优先采购
近日,国家医保局办公室发布《关于完善新冠治疗药品价格形成机制实施分类管理的通知》,对医保药品目录外的新冠治疗药品实施价格风险分类提示,分为A、B、C三类。
A类药品,是指按照《新冠治疗药品价格形成指引(试行)》进行首发报价或评估调整,疗程治疗费用与医保药品目录内同类药品差异较小的新冠治疗药品;B类药品,是指按照《指引》进行首发报价或评估调整,疗程治疗费用与医保药品目录内同类药品差异较大的新冠治疗药品;C类药品,是指未按照《指引》完整进行首发报价或评估调整,以及评估结果明显不公平不合理的新冠治疗药品。
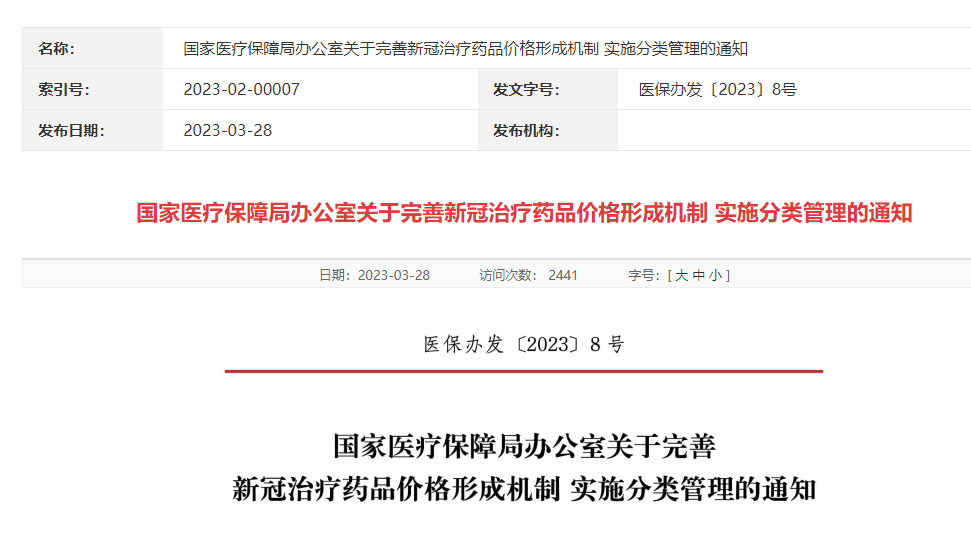
图片来源:国家医保局办公室
国家医保局要求已挂网新冠治疗药品于4月1日前进行首轮价格评估,企业可以补充完善材料,提交价格调整承诺,调整后价格符合条件的纳入A类管理,其他则按B类或C类管理。
《通知》说明,现阶段A类药品疗程治疗费用暂以医保支付范围内当期价格较低的小分子新冠治疗药品最大疗程治疗费用为参照基准,企业遵循《指引》进行首发报价或评估调整挂网价格后,疗程治疗费用不高于参照基准的1.8倍。
同时,自2023年4月1日起,对于A类药品,各省级医药采购平台将其名称字体或背景显示为绿色,引导采购单位优先采购;对于B类药品,各省级医药采购平台将其名称字体或背景显示为黄色;对于C类药品,各省级医药采购平台将其名称字体或背景显示为红色,并以弹窗等醒目方式向采购单位提示相应风险。
三、新冠没有消失,首个国产新冠药已停产
今年以来,新冠疫情已经趋于稳定。但新冠没有消失,只是处于低水平流行状态。据中国疾控中心最新发布的全国新型冠状病毒感染疫情情况,自3月3日以来,我国新冠病毒核酸检测阳性数呈波动下降趋势,每日报告核酸检测阳性数仍保持在4000人左右。
新冠疫苗、药物的研发和审批也在继续。随着越来越多变异毒株的出现,新冠中和抗体的治疗选择范围越缩越小,同时面对众多小分子药物竞争。值得一提的是,近日,腾盛博药发布公告,决定结束安巴韦单抗/罗米司韦单抗联合疗法项目,并已停止生产工作以将资源重新转向核心项目,停产是因为不断演变的疫情趋势。
安巴韦单抗/罗米司韦单抗全球研发详情
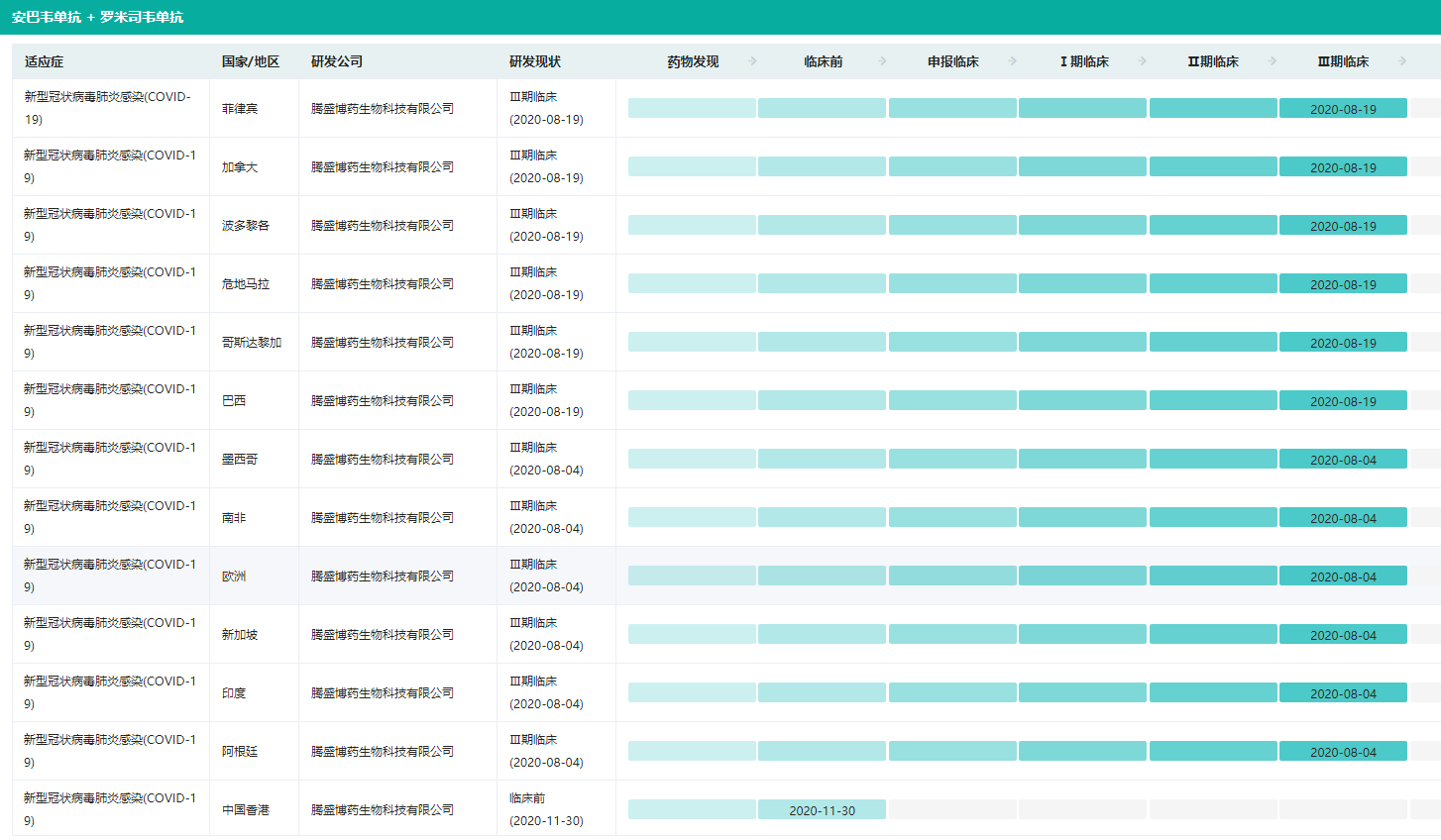
图片来源:药融云全球药物研发数据库
安巴韦单抗/罗米司韦单抗是腾盛博药与清华大学、深圳市第三人民医院合作研发的新冠病毒中和抗体联合治疗药物,也是国内首款获批的新冠新药,从获批到商业化经历了8个月,从商业化到停产也只经历了8个月。安巴韦单抗/罗米司韦单抗研发投入达2亿美元(约合人民币13.78亿元),上市半年多时间,仅为腾盛博药带来5160万元收入。
在国内新冠类药物市场上,中和抗体、口服小分子药物和疫苗互为补充。相较于抗新冠病毒小分子药物,中和抗体的优势在于副作用小、药物相互作用 (DDI)少,适用人群更广,但劣势是难以应对病毒S蛋白突变,生产成本高,储存运输条件严格,注射给药患者依从性低等。
药融云数据库显示,除了腾盛博药的安巴韦单抗/罗米司韦单抗联合疗法(仅在国内获批),全球范围内曾获得紧急使用授权或获批上市的中和抗体疗法,还包括阿斯利康的Evusheld、葛兰素史克的Sotrovimab、礼来的bamlanivimab及bebtelovimab、礼来的bamlanivimab/etesevimab联合疗法、以及再生元/罗氏的REGEN-COV。阿斯利康的Evusheld是用于预防新冠,其余均用于治疗。
2021年新冠中和抗体试产规模110亿美元,在抗体药物靶点类型中位列第四。药融云跨国药企销售数据库显示,2021年,再生元和罗氏合作开发的REGEN-COV达到75.74亿美元市场规模,礼来与君实生物推出的组合Bamlanivimab/Etesevimab也达到22.39亿美元。
再生元REGEN-COV销售数据查询
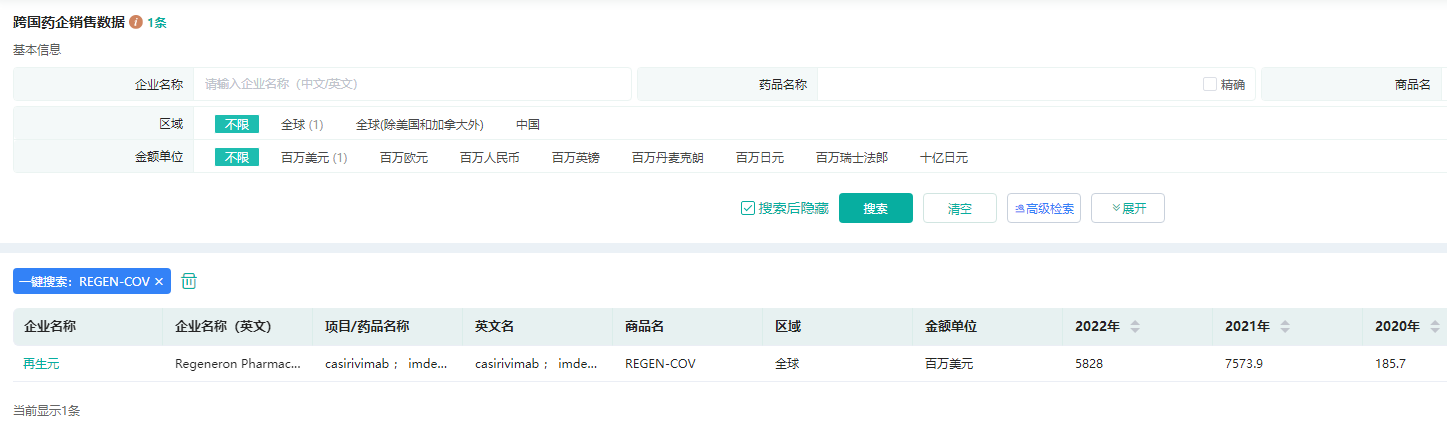
图片来源:药融云跨国药企销售数据库
2022年,礼来的组合疗法全年合计销售额下滑10%,REGEN-COV的营收为58.28亿美元,也大幅下降。国际赛道上,可谓几家欢喜几家愁。葛兰素史克凭借多个市场获批的Sotrovimab创收23.09亿英镑,相较2021年增长超一倍。2021年底获批的Evusheld,也在2022年为阿斯利康带来21.85亿美元。
但时间来到2023年,随着1月下旬FDA撤销了对阿斯利康Evusheld的EUA(美国应急使用授权),至此,在美国投入使用的六款中和抗体全线败退。一度热闹的中和抗体赛道,变得门可罗雀。与大部分热点相似,新冠中和抗体的命运似乎也在逐渐走向尾声。
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论