药融圈:“出海热”为生物医药企业带来了新机会,同时也带来了新问题,其中,如何与FDA进行有效沟通,加快新药临床试验申请(IND)可以说是最引人关注的话题。
在药融圈主办的“第四届改良型新药趋势与合作交流大会”上,三位具有FDA工作经验的专家——美国安诺律师事务所驻上海代表处管理合伙人陈少羽,天士力控股集团全球副总裁、天士力医药集团副董事长孙鹤,益琳睿安医药咨询有限公司CEO原瑞华直面正在出海或计划出海的国内药企,答疑解惑。充分的准备与沟通的技巧是他们总结出的心得与重点。
一、充分准备与一点技巧
从计划进入美国开展临床研究,企业就开始了与FDA打交道的过程,企业关心实际上集中在整个过程中的方方面面。几位专家在分享中谈到的共性问题,有关企业自身准备、产品数据、巧用流程以及沟通技巧。
充分的准备可能是沟通交流顺畅的一大基础。孙鹤表示,一般在提交申请前,企业需依据FDA的公开指南和法规比对申请材料。逐一筛查不仅可以查缺补漏,还可以让企业对同类药品在美国现阶段的研发情况有更清晰的理解。他以抗癌类药物举例说明,以往FDA对抗癌类药物的审批态度很积极,彼时抗癌类产品数量少,各项数据出众的好产品更少,导致这一时期FDA对抗癌类药物的放行标准相对偏低。现在,FDA对药品的审批要求则不再仅仅局限于药品的适应症,而是涉及到最优剂量等诸多方面,要求更为详细具体。如果企业可以通过临床药理学模拟实验、动物实验,甚至根据中国的临床试验等,详细论证最优剂量等数据的由来可以极大提高药品审核通过的可能性。也就是说,企业提供的信息越能显示出研究的深入,更有可能加快药品获批速度。
数据是FDA审查中最关键的一环。原瑞华正是从这一角度提出了建议:企业要重视对数据的理解,只有更加透彻理解,确保各类试验数据的充分完整,才能在与FDA面谈时通过展示证明数据的真实可靠。面对FDA时不被问倒,这样会使沟通更加顺利。
除了前期做好充分的准备,专家们表示,在与FDA交流过程中,药企还可以考虑多样的交流方式和流程规则的合理应用。
企业与FDA进行正式会谈前,可以根据自身情况合理利用Pre-IND,比如咨询一些指导文件和其他公开信息没有明确阐述的问题,降低临床搁置的风险。
孙鹤表示要合理利用Informal Meeting与FDA沟通。比如可以采用邮件、电话、视频等方式与FDA就存在的问题进行沟通,因时间有限不能在正式会议上全部展示的,可以做一个书面补充,着重展示产品亮点。谈到多样的展示方式,孙鹤讲述了自己在与FDA面谈时的一个真实经历,FDA对国内的中药研发存在一些不切实的固有认知,于是他在一次面谈中改变了展示方式,将国内一些重要中药企业的生产环境甚至于生产流程都拍了小视频,展示给FDA,让他们意识到中国的中药研发及生产已经发展到这种程度。“所以合理利用这些方式能够帮助企业获得更多的展示机会,进而提升获批概率。”
交流过程中放平态度其实也很关键。
在孙鹤看来,面对FDA提出的疑惑,药企要在第一时间给予回应,有问题要及时讨论,不要因为紧张或是害怕沟通,在没确认问题时就一口答应。这也有很多实例说明,孙鹤曾帮一家法国企业向FDA递交IND申请,面谈时FDA让企业再补做一个Ⅲ期临床试验,法国企业的同事当时就不停地点头,等面谈结束回来讨论,才发现是需要要重新做Ⅲ期临床试验。后来,孙鹤提议申请FDA的follow up流程,及时与FDA沟通说明试验情况,企业又将数据重新整理并提交给FDA,最后FDA撤回了补做Ⅲ期试验的要求。
法国企业这个例子,是因为沟通过程中语言障碍导致双方对问题的理解有偏差,最后不得不与FDA重新沟通。所以,中国出海药企在沟通过程中,遇到不清楚的,可以向对方说明没有完全理解,请对方再重复一次,或者是向对方表达自己是如何理解这个问题,向对方确认问题,以更好地解决问题。
最后,从自己的专业出发,陈少羽详细介绍了企业如何利用FDA回执的三个阶段合理维权。FDA在收到新药临床试验申请后,如果书面存在明显瑕疵,FDA有责任与义务在发现的第一时间通知企业进行修改;在受理的90个工作日以内,FDA会根据具体申请情况将相关问题告知企业;在受理的90个工作日以后,FDA会出具一份关于该申请的完整性回复。如果在这个过程中,存在因受理方失职造成的不良后果,可以向FDA的行政部门及其自有法院申请维权。
二、现场审查的侧重点
现场还有人提问,企业如何应对FDA的现场审查或者说FDA现场审查具体审查什么内容?这是企业出海走到后期阶段会遇到的问题。
原瑞华表示,FDA对企业进行现场审查,其目的是进一步确认申请材料提供的数据是否真实可靠。大多数企业在进行现场审查准备时,侧重于漂亮的数据,和试验基地。但仔细回溯过往审查,不难发现FDA对硬件只要求达到标准即可,更加重视的是质量体系、人员培训以及临场应答的反应等。举个例子,当FDA工作人员指出现场问题时,企业能否第一时间给予回应并解决,假设该问题暂时无法解决,能否详细说明是短期问题还是偶发性问题,同时要明确给出解决问题的具体时间。
她还提醒企业,面对FDA的现场提问时要关注其背后的用意,现场提问通常不是为了确认某个单一数据的准确性,而是想借此找到一个缺口,进而考察企业递交的整个报告数据是否具有逻辑性、一致性、完整性,从而判断数据是否真实可靠。
孙鹤还补充道,企业在做内部稽查时应重视质量体系,尤其是QA(quality assurance)部分的准备,这将非常有利于现场审查。
FDA的探究不仅于此,8月3日-4日,第五届CMC-China制药博览会现场与您探讨!更多议题下滑查看!
扫描下方二维码报名
▽

*议题更新中,以会议现场为准
*议题更新中,以会议现场为准
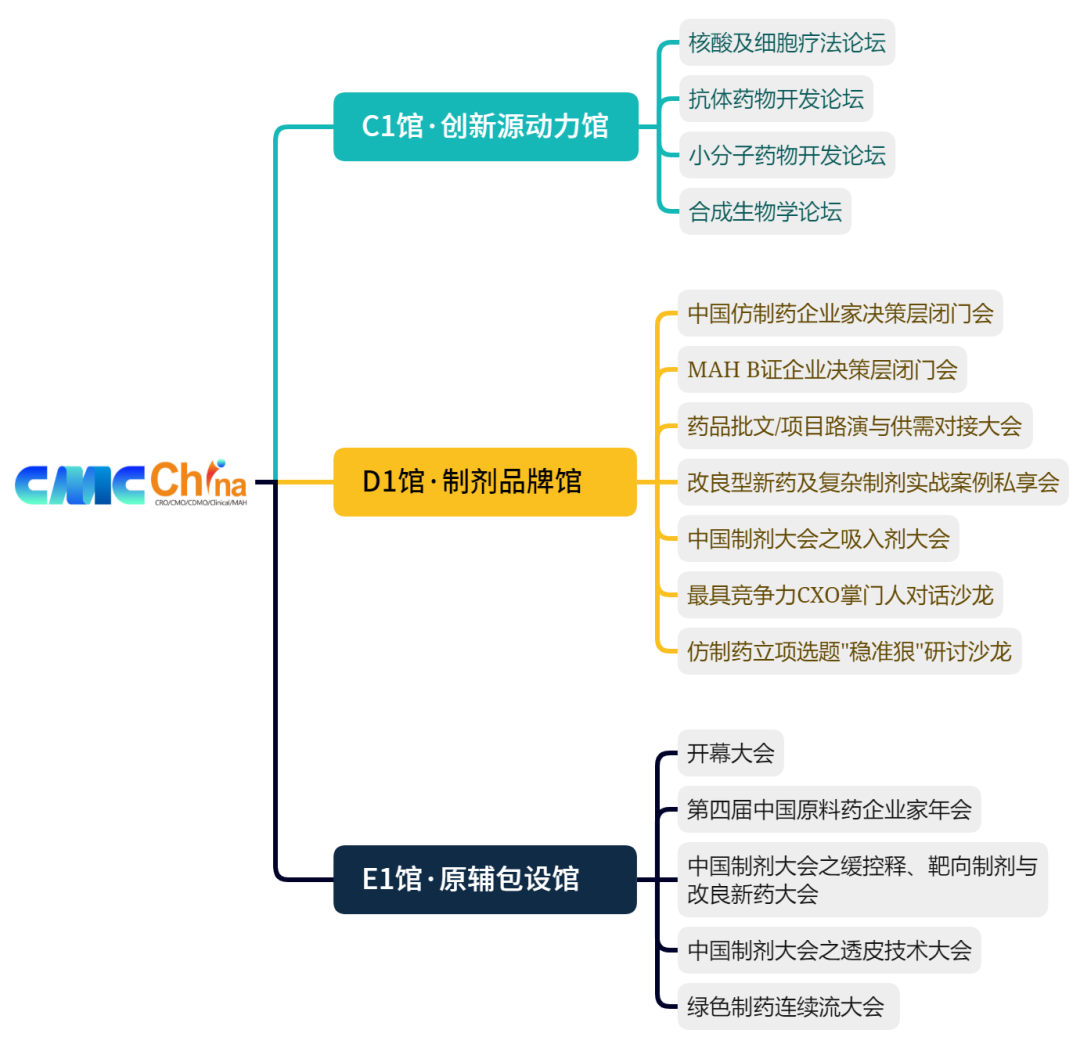
C1馆-创新源动力馆

D1馆-制剂品牌馆
01.#中国仿制药企业家决策层闭门会
• 新形式下仿制药企业战略布局
• 用消费品的思路重新在做一遍OTC药品
• 中国仿制药决策层核心观点碰撞
• 2023预见未来——仿制药企业十大趋势(伴随阵阵红包雨)
• 核心观点:“项”阳而生——仿制药立项观点分享
• 企业掌门人供需发布
• 核心观点:寻找增量——企业突破迷茫期,破茧成蝶
02.#MAH B证企业决策层闭门会
• 药监专场—MAH制度下全国B证许可现状及行业趋势分析
• 成本管控Tips:MAH委托各环节成本控制大法
• B证创始人:需求发布
• 抱团取暖—B证企业之间如何实现资源共享
• 情景剧:像买古董一样买批文
• MAH&CMO较量之B证企业如何识别受托生产企业共线风险
• 四巨头大PK:原料药、CRO、CMO、MAH
03.#药品批文/项目路演与供需对接大会
• 避坑指南:买买买的关注要点及注意事项
• 种草攻略:大数据精准挖掘中国好批文!
• 300个批文/项目真实买家
• 1000个优质批文/项目路演
• 30000个在研项目/批文滚动发布
• 股权融资路演专场
• 高校产学研项目对接会
• 跨国药企买家团打卡
• 综合型央企、国企买家团打卡
04.#改良型新药及复杂制剂实战案例私享会
• 战略分享:以临床价值为导向的改良型新药研发策略
• 政策解读:从技术审评的角度谈创新药立项策略
• 20+改良型新药成功案例分享
• 50+复杂制剂研发经验分享
• 30+全国顶级高校教授团队最新复杂制剂成果展示
• 儿童用药、中药制剂、纳米制剂、微球制剂、混悬液、口溶膜、冻干口崩、眼用制剂等各类产品剂型展示
☆ 会场外将设置各类药物制剂剂型产品“微展台”,欢迎各制剂研发CRO、CDMO、CMO等企业提供可研发、生产的样品或照片进行多方位展示,展品包含但不限于:
• 特色固体制剂,如双层片、多层片、片中片、微片等...
• 各类特色包装的注射剂,如粉液双室袋等...
• 各类包装的吸入制剂,如粉雾剂、气雾剂等...
• 各类包装的液体制剂,如条包装、玻瓶装等...
05.#中国制剂大会之吸入剂大会
06.#最具竞争力CXO掌门人对话沙龙
• MAH选择CRO、CDMO、CMO、API的基本因素考量
• 以制剂技术平台赋能MAH产品管线设计
• 优秀CMO必备技能——高效的技术转移
• 圆桌:从服务模式到批文模式——CXO转型对话
#07.仿制药立项选题"稳准狠"研讨沙龙
• 从企业战略出发,落地立项实操
• 从技术审评的角度谈仿制药立项策略
• 高难度制剂立项前的思想准备
• 仿制药面临的专利困境及企业专利挑战案例分析
• 从小白到高手,手把手教你快速完成项目立项报告
E1馆-原辅包设馆
01.#开幕大会
02.#第四届中国原料药企业家年会
03.#中国制剂大会之缓控释、靶向制剂与改良新药大会
• 全球缓控释制剂最新进展综述
• 兼顾临床需求和品种商业价值的缓控释制剂立项策略
• 口服缓控释制剂的成药性、必要性、与审评考量
• CDE审评中缓控释制剂常见问题及案例沟通
• 亲水凝胶骨架片仿制药研究时片形及薄膜包衣配方选择
• 微球在缓控释制剂领域的最新应用进展研发的关键技术
• 缓控释类药物在生物等效临床中设计和体验
• 流化床微丸包衣工艺与制粒工艺关键技术
• 双螺杆挤出制粒在缓控释制剂开发中的应用案例
• 选择不同的压片机,对片剂溶出性能的影响到底有多大?
• 羟丙甲纤维素在缓控释制剂中的应用案例
• 最新溶出仪器提高缓控释制剂开发效率案例分享
• 肠溶胶囊、植物胶囊怎么选?实战案例分享
• 适合的才是最好的--选PVC、PVDC还是阿克拉?
• 适合的才是最好的--冷铝、热带铝、双铝、复合膜怎么选?
• 适合的才是最好的—高速泡罩包装机、装盒机如何为制药企业降本增效?
• 适合的才是最好的—胶囊充填机应该怎么选?
• 适合的才是最好的—注射给药系统的合理化选择
• 缓控释技术、微球、定量给药装置、高端制剂装备领域当前投资热点
04.#中国制剂大会之透皮技术大会
• 全球透皮制剂行业重点企业、重点品种、未来趋势
• 中国透皮制剂领域未来3-5年市场机遇分析
• 国内透皮制剂研发和申报进度靠前的企业和品种巡礼
• 透皮制剂从立项到获批全过程关键点、曾经掉进过哪些坑,如何爬出来的?
• 洛索洛芬钠凝胶贴膏,为何在上市第一年就能卖出15亿?
• 院内?院外?线上?线下?2025年众多透皮制剂品种扎堆上市之后,如何兑现销售预期?
• 集采之后,化药透皮剂的产品战略和盈利模式
• 透皮制剂改良型新药的项目立项逻辑及实际案例
• 如何加速推动透皮制剂改良型新药的研发?
• 日本透皮技术合作项目介绍+ 1对1商务对接(项目包含化药透皮制剂、汉方透皮制剂、药妆、医美领域)
05.#绿色制药连续流大会
*议题更新中,以会议现场为准
扫描下方二维码报名
▽

<END>


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论