
背景
完美的药物应该犹如保罗·埃利希(Paul Ehrlich)所提出的神奇子弹(magic bullet)一样,药物很容易的给药(顺应性),能够被完全吸收(良好的生物利用度),转运到所需要的治疗靶点(靶向性),起到应有的疗效,然后被身体完全清除。理想很丰满,现实很骨感。据不完全统计,在进入临床研究阶段后,90%的候选化合物会在I、II、III期临床试验和药物上市审批阶段中,因为缺乏临床疗效(40%-50%)、无法控制的毒性(30%)、类药性差(10%-15%)、缺乏商业需求或战略规划上的失误(10%)而失败。(相关阅读:理清API小试研究阶段的分析工作决策树)
加速I期
面对临床试验失败率居高不下,世界各地的监管机构采取了多项举措来促进早期人体试验的快速推进。FDA在2006年发表了关于1期探索性研究的指南,允许早期人体试验的临床前测试少于传统研究性新药(IND)申请所需的数量。大约在同一时间,欧洲监管机构提出了一项微剂量研究,该研究涉及施用单次亚药理学剂量的化合物,以获得对药代动力学、分布和/或受体选择性的早期评估。
探索临床试验通常是在I期临床试验早期进行的,它不以治疗为目的,也不侧重于检测药物的临床耐受性,如人体的最大耐受量,在研究过程中只涉及到少数人群并使用有限剂量,最终通过有限的人体暴露获取相应的临床参数。探索性临床试验是新药IND申报的评价内容,其可以探索药物的初步安全性和有效性,了解剂量与效应的关系,明确药物治疗的最小有效剂量和最大耐受剂量,为确证性试验推荐给药方案。
在首次人体试验(FIH)研究中,在选择新的化学实体(NCE)时,仅从体外和/或计算机工具无法很好地预测药物及其制剂的体内行为。需要尽早确定风险、挑战和策略,以准备在动物毒理学研究和FIH临床试验中提供足够临床前暴露的制剂。
拜尔决策树评价标准
临床1期研究的API配方选择首先在开发候选化合物选择阶段形成,为其生成全面的体外和体内数据集。该分析包括深入的物理化学、药理学、DMPK和毒理学表征,作为决定哪种候选化合物将进入临床前开发的基础。临床1期研究配方和早期动物配方具有很强的相关性,特别对于难溶性药物制剂增溶配方。早期制剂开发中满足足够的体内暴露成为首要目标。
体内研究注定是需要花费大量的时间和资源的,无数的科学家在积极的探索通过体外的表征去预测药物制剂的体内行为。预测制剂体内性能已经研究了20多年。尽管如此,在药物发现阶段,先导优化和候选化合物选择的处方前科学家面临着艰巨的任务。在选择新的化学实体(NCE)时,需要有关药物在生物相关条件下从制剂中溶出的信息,但目前仅从体外和/或计算机工具中无法很好地获得这些信息。在动物毒理学研究和患者临床试验中提供足够临床前暴露的制剂的制备需要对相关风险、挑战和开发策略进行早期评估。所采用的方法可能不同,但通常包括考虑关键因素组合的逐步方法,如与API在生物相关介质中的溶解度相关的口服剂量,即生物相关剂量数(DN)。此外,关于API特征的体内、体外和计算机信息对于补充单参数概念是必要的,例如溶解所用剂量的体积(VDAD),这与DN概念密切相关。
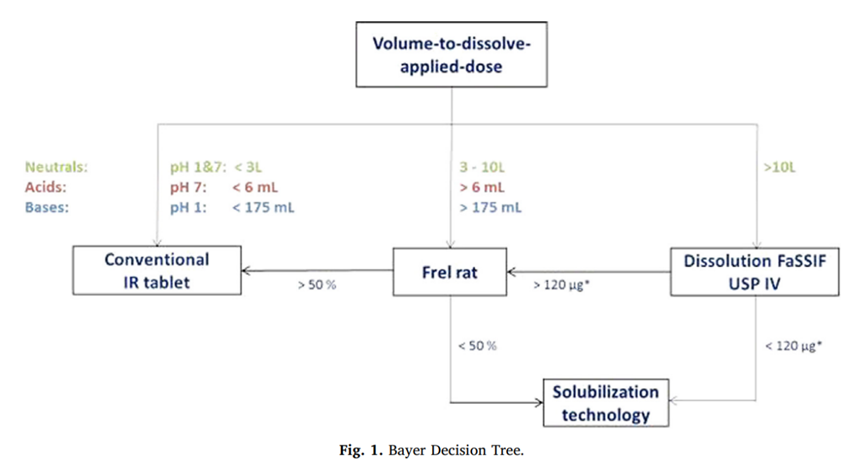
本文通过对于拜尔公司内部的制剂开发决策树的介绍,助力新药开发过程在早期阶段通过几个体外或者动物体内的参数,去指导后期制剂开发策略。拜耳临床1期研究候选化合物制剂开发类型的决策基于(i)在人体内溶解所施加剂量(VDAD)所需的体积,以及(ii)在大鼠体内以混悬液与溶液的形式口服给药的微粉化晶体化合物的相对口服生物利用度(Frelsusp/sol)。
VDAD的计算基于结晶的、无溶剂的、微粉化的API在pH1(0.1M HCl)和pH7(磷酸盐缓冲液)的水溶液中测得的热力学溶解度和预测的人类治疗剂量。
如果中性化合物VDAD小于3L,酸性化合物VDAD在pH7时小于6mL,碱性化合物VDAD在pH1时小于175mL,则建议化合物开发常规立即释放(IR)片剂。对于其他情况,应进行大鼠Frelsusp/sol研究,并用于以下决策:简言之,将受试化合物以两种不同的制剂,以mg/kg为基础,以估计的人类治疗剂量口服给药雄性Wistar大鼠:
(i)例如乙醇/PEG400/水(10/50/40)或乙醇/Solutol/水(10/10/70)最佳载体为基于溶解度数据选择,以确保化合物以溶液的形式应用,和
(ii)由0.5%Tylose溶液组成的混悬载体,其中相应的化合物以微粉化的形式混悬。
在给药后24小时内收集血浆样本,并通过LC/MS/MS进行分析。使用标准PK软件根据血浆浓度-时间曲线估计药代动力学参数。Frelsusp/sol计算为从混悬液与溶液组获得的AUC比率。基于与Frelsusp/sol回顾性比较,在人类中获得的数据,在大鼠中具有Frelsusp/sol值大于50%的原料药符合常规IR片剂制剂的开发条件,而对于具有Frelsusp/sol值小于50%的原料药,则表明了增溶制剂(EF)的开发(图1)。
参考文献3
注意事项
拜尔决策树已成功应用于多个适应症的许多药物发现和开发项目,但强调对于每个新药开发候选化合物的配方表征的可靠性是至关重要。其中一个方面涉及大鼠Frelsusp/sol研究中的溶液组,其中必须确保化合物完全保留在溶液中,即不会在体内GIT中沉淀,从而导致过高估计susp/sol值。因此,在进行体内研究之前,需要非常谨慎地选择大鼠Frelsusp/sol的配方。首先,由于过饱和溶液倾向于在体内的GIT中沉淀,必须确定能够实现化合物完全溶解的制剂制备。其次,还必须在体外沉淀测定中测试该制剂,以确定其在体内研究中沉淀的可能性。
拜尔决策树使用的化合物组的人体剂量范围也需要格外的关注。所用数据集中的大多数化合物都是以低于200mg的人体剂量施用的。当对预计人体剂量超过该剂量范围的化合物使用拜尔决策树时,需要考虑这一点。对于这类化合物,在生物相关介质中增加剂量的体外溶出试验具有特别重要的意义,以便能够预测人1期剂量递增的不同剂量步骤的吸收行为。虽然过去的决策主要基于水性缓冲液中的溶解度估计,但现在越来越多地通过从生物相关介质中得出的估计来实现。此外,基于生理学的口服吸收模型也越来越多地支持项目支持和决策。
案例分享
在文献中仍然缺乏药物在人类或动物中实验推导的体内溶出数据与体外剂量/pH依赖性溶解度或溶出数据的直接相关性。这种体外-体内相关性(IVIVCs)将允许建立一定的pH依赖性体积来溶解所施加的剂量(VDAD),这可以指导制药科学家选择配方。例如,在药物研发机构的后期研究/早期开发阶段,一个标准问题是:“我们可以使用含有结晶API的标准速释片吗?还是需要增溶技术?”根据上文拜尔公司提供了一个绝妙的决策树,而且实例也证明其在药物开发早期指示配方开发的方向。
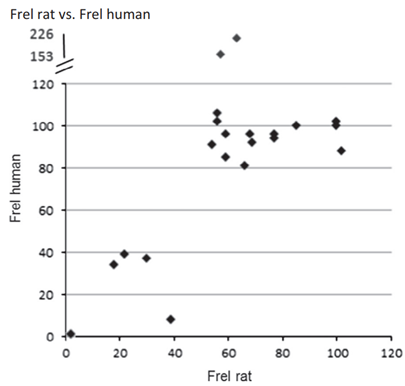
图2 雄性Wistar大鼠的Frel曲线图(来自混悬液的AUCnorm/来自溶液的AUCnorm*100[%])与Frel人的对比图(来自含有微粉化结晶药物的常规速释片剂的AUCnorm/来自溶液AUCnorm*100%[%])(参考文献4)
为了进一步说明上述决策树的实用性,实例中,拜尔研究了22种结晶化合物的pH依赖性VDAD与口服片剂和溶液在人类中的药代动力学数据。为了寻找可预测的体内动物模型,绘制了Frel大鼠(口服混悬液与溶液)与Frel人类的对比图。生成了相应的IVIVC,并用于创建可开发性决策树。
为了使用Frel大鼠数据预测人体溶解性和/或溶出受限吸收的可能问题,绘制了Frel大鼠数据与Frel人数据的对比图。该图在一定程度上揭示了Frel大鼠与Frel人的相互依存关系。图2表明,如果Frel大鼠>50%,则Frel人的高几率>80%,这表明没有溶解性和/或溶出限制吸收问题。
总结与展望
拜尔决策树使用药物开发候选化合物所预测人类治疗剂量,用于大鼠的Frelsusp/sol研究,并计算在人类中溶解该剂量所需的体积。在不同pH值的水性缓冲液中测定溶解度,并测定在该开发阶段与API在IR片剂中尽可能接近的化合物状态,即规定晶体API平均粒径为d50<10µm。拜尔决策树应用于不同电荷状态的化合物,即它们在GIT的不同部分中的中性、碱性或酸性。该信息与预测的人类治疗剂量的使用一起用于估计给定候选化合物的任何潜在溶解度限制和/或溶出限制吸收问题。此外,还通过以溶液形式给药的化合物的临床前物种的绝对口服生物利用度和体外Caco-2测定中的渗透行为来评估人体的口服吸收行为,以确定任何渗透性有限的吸收问题。拜尔决策树的优势来自于基于20多种内部化合物的临床验证,这些化合物已经生成了人体Frelsusp/sol数据(IR片剂与液体制剂)和大鼠的Frelsusp/sol数据。根据所使用的数据集基于大鼠的临界Frelsusp/sol值定义为50%,进而推荐使用常规IR片剂或EF开发。
参考文献:
1.新药临床试验之探索性临床试验
2.Why 90% of clinical drug development fails and how to improve it?
3.In vivo models and decision trees for formulation development in early drug development: A review of current practices and recommendations for biopharmaceutical development
4.Predicting biopharmaceutical performance of oral drug candidates Extending the volume to dissolve applied dose concept
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论