
12月29日,据国家药监局官网显示,天麦生物引进的 重组人胰岛素肠溶胶囊(ORMD-0801)收到药品通知件,即未能获批上市。该申请于2023年4月递交,申报的适应症为用于治疗口服降糖药疗效不佳的2型糖尿病患者。

截图来源:国家药监局官网
ORMD-0801 是Oramed利用其专有的口服递送技术平台PODTM开发的一款口服胰岛素胶囊,由肠溶包衣、蛋白酶抑制剂、吸收促进剂和胰岛素4部分组成。
肠溶包衣对pH敏感,可避免胶囊在胃部被强酸环境破坏,从而使内容物在进入小肠之前保持完整;蛋白酶抑制剂可以减少胃肠道中的蛋白酶对胰岛素的降解;吸收促进剂可以增强小肠壁对胰岛素的吸收。

图源:Oramed官网
2015年11月,天麦生物与Oramed达成协议,以5000万美元的总交易额获得 ORMD-0801 的中国(包括香港和澳门)权益。
2023年Oramed公司宣布,其三期临床试验失败,没有达到终点。
但在国内,天汇还是继续推进产品的上市工作,在同年4月,天汇提交了上市申请。
既然国外失败,国内又怎么能够申请上市?
首先,口服胰岛素 ORMD-0801 的美国Ⅲ期临床试验结果至今未公开,Oramed仅宣布其未能达到主要与次要终点。
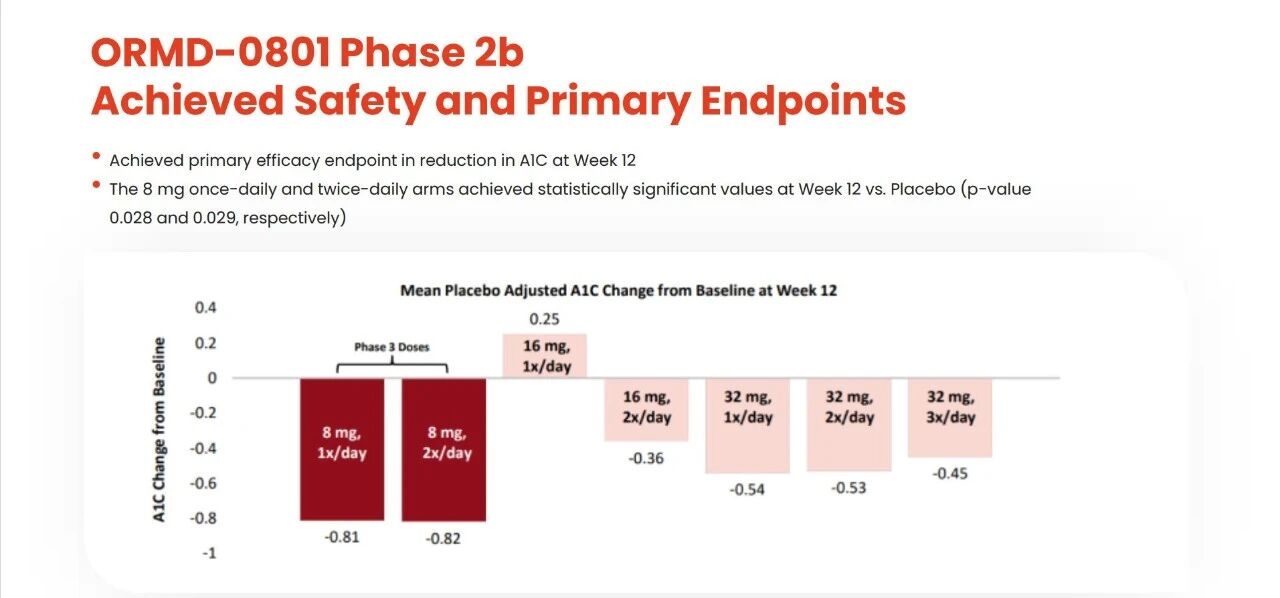
此前在Ⅱb期临床中,虽然该药在改善糖化血红蛋白等关键指标上达标,但已显示出异常的量效关系:最低剂量(8mg)组的疗效最优,而16mg、32mg剂量组的改善反而不及低剂量组。
此外,每日给药一次的疗效不及每日两次。这些矛盾的数据结果,已为后续的Ⅲ期临床失败埋下伏笔。
ORMD-0801 Ⅱb临床试验结果
根据天麦生物与Oramed的协议,ORMD-0801 的中国区权益归天麦所有。为挽救该项目,其国内Ⅲ期临床试验设计较美国方案进行了显著"优化"。以下是两项关键研究的主要差异对比:
中美Ⅲ期临床试验设计差异
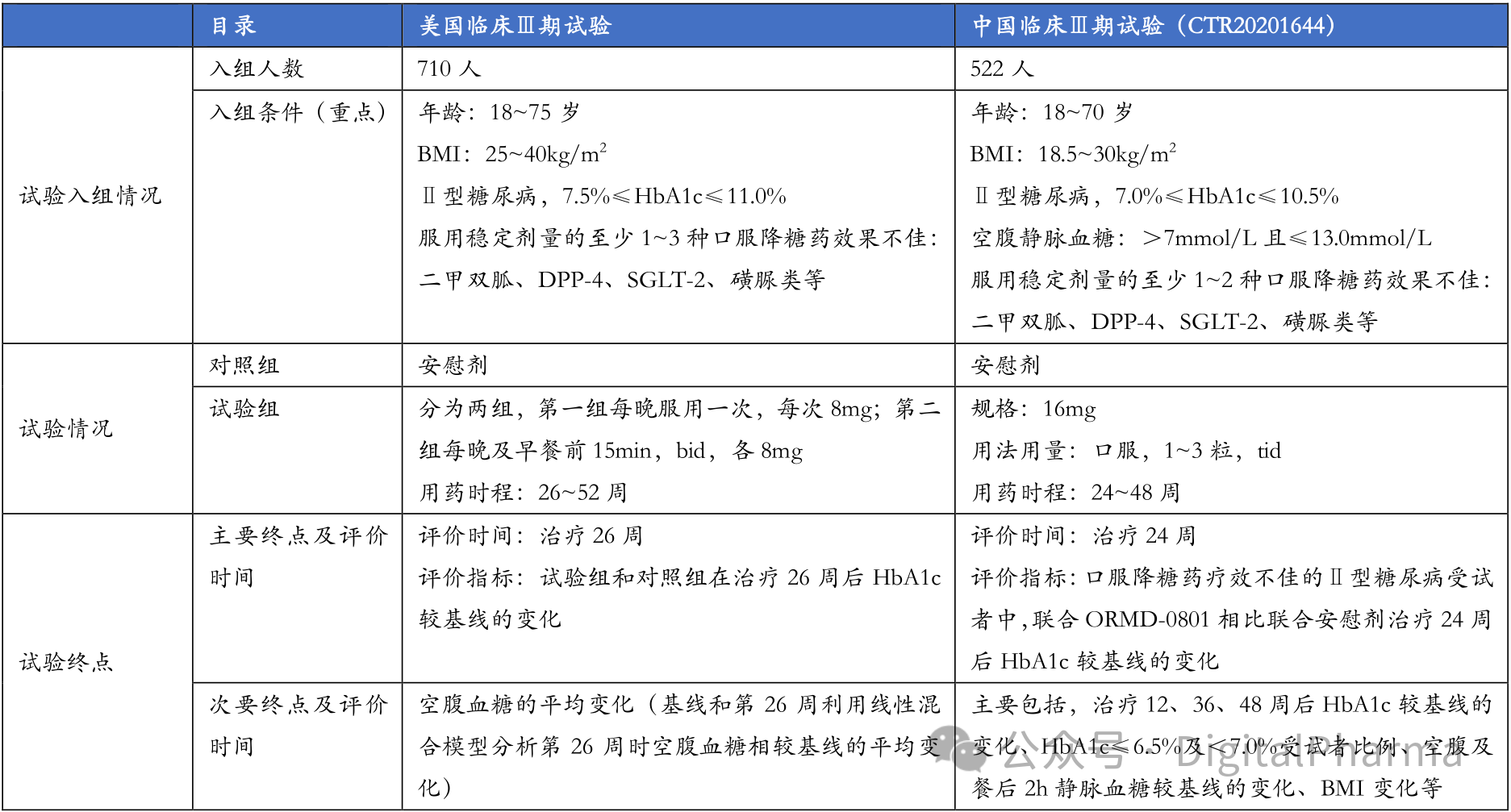
不难发现,中国临床Ⅲ期试验相对于美国Ⅲ期,主要终点和次要终点的试验设计似乎更为合理,但是中国Ⅲ期试验16mg的规格和给药其剂量远高于国外,另外,在入组条件上,可以看出中国境内受试者病症比美国受试者相对来说更轻,但入组人数低于美国,按常理来说,入组人数越多,试验结果可信度越高,这样一看,总结下来,轻病症,高剂量......
参考来源:
[1] NMPA官网
[2] 药物递送
[3] Digital Phrama
扩展阅读:
1. 做一次内镜停用胰岛素?T2DM创新微创消融术将开展大型试验
2. 甘李药业GZR4超长效胰岛素启动III期临床试验,国产胰岛素新突破!
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论