导读:2021年5月18日,CDE发布,关于药品专利纠纷早期解决机制相关专利信息登记平台公开测试等有关事宜的通知,CDE正式发布《中国上市药品专利信息登记平台》,测试时间至5月31日;
2017年10月09日,总局官网转发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》其中明确提出探索建立药品专利链接制度。

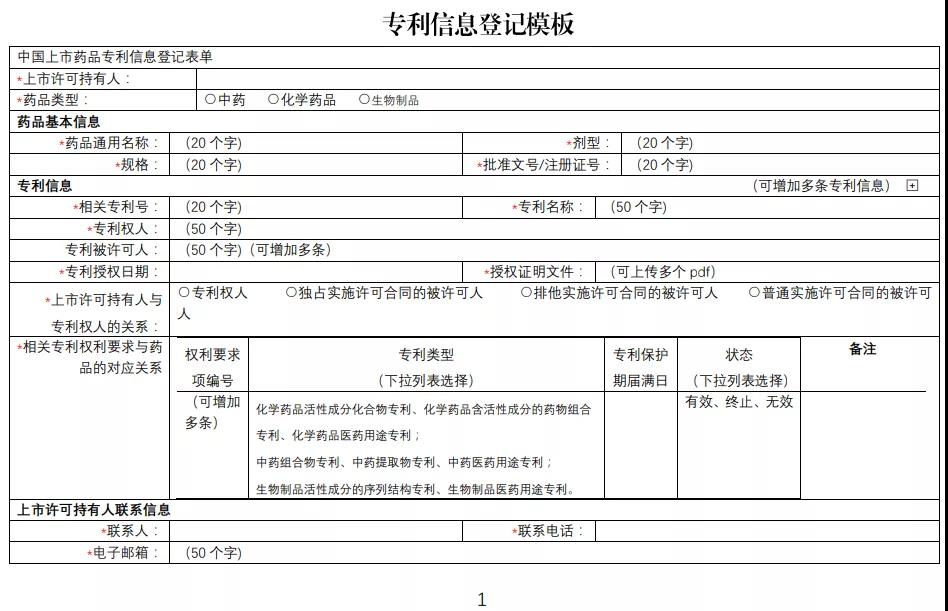
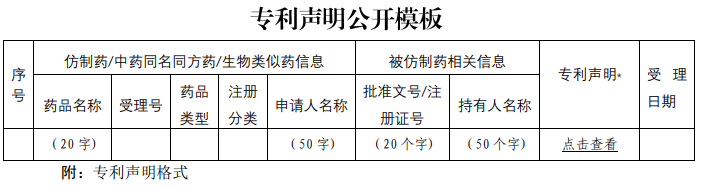
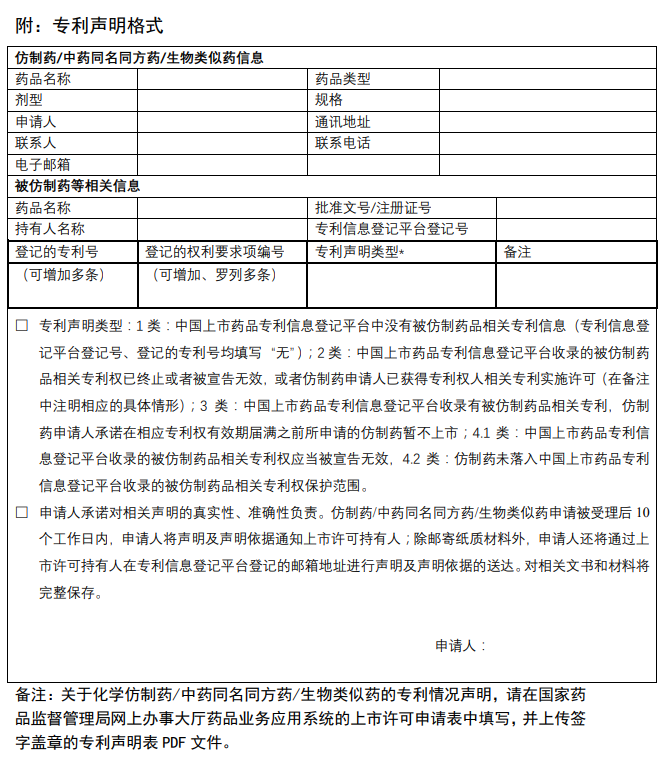
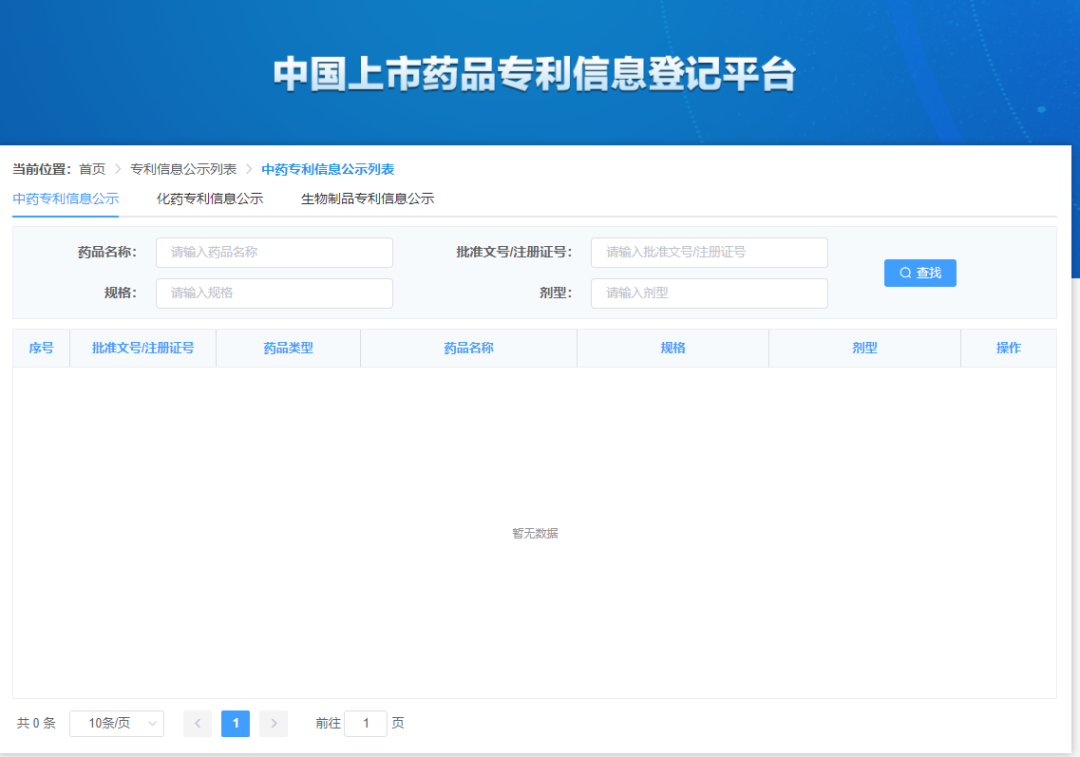
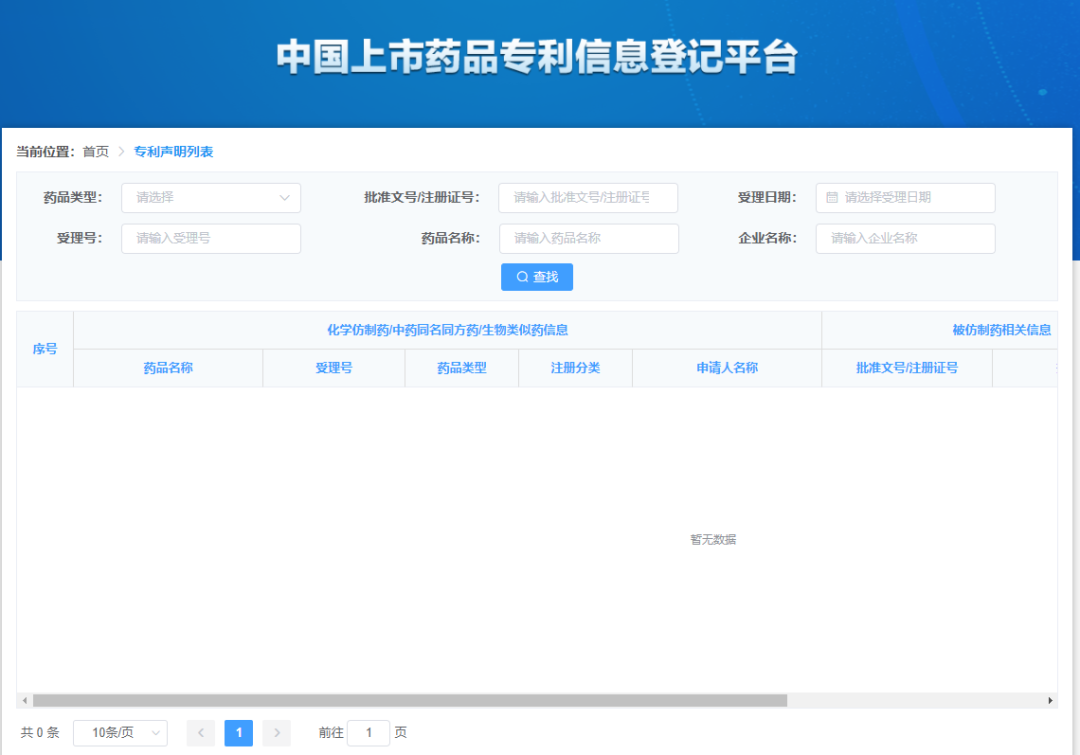
为贯彻落实《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》以及《专利法》有关规定,国家药监局会同有关部门积极推进药品专利纠纷早期解决机制实施办法的制定和出台。为配合办法实施,根据国家药监局整体工作部署,经内部讨论和征询专家及相关部门意见,我中心搭建了中国上市药品专利信息登记平台,并附填表说明、专利声明公开模板。现对登记平台开展公开测试,并征集各方意见。测试地址:https://zldj.cde.org.cn。
请已在中国上市药品的上市许可持有人积极参与相关药品专利信息登记测试。为便于工作衔接,待药品专利纠纷早期解决机制的办法实施后,测试期间已按要求登记的相关专利信息经药品上市许可持有人确认后公开,作为化学仿制药、中药同名同方药以及生物类似药申请人作出专利声明的依据信息。请药品上市许可持有人确保所登记信息的真实性、准确性、完整性。测试时间至5月31日。同时也欢迎社会各界提出宝贵意见和建议,以便我们持续完善。您的反馈意见请发至 zhangxx@cde.org.cn,抄送yjjdc@nmpa.gov.cn,并注明主题“中国上市药品专利信息登记平台”。
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2021年5月18日



关联阅读:
三、促进药品创新和仿制药发展
(十六)探索建立药品专利链接制度。为保护专利权人合法权益,降低仿制药专利侵权风险,鼓励仿制药发展,探索建立药品审评审批与药品专利链接制度。药品注册申请人提交注册申请时,应说明涉及的相关专利及其权属状态,并在规定期限内告知相关药品专利权人。专利权存在纠纷的,当事人可以向法院起诉,期间不停止药品技术审评。对通过技术审评的药品,食品药品监管部门根据法院生效判决、裁定或调解书作出是否批准上市的决定;超过一定期限未取得生效判决、裁定或调解书的,食品药品监管部门可批准上市。

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论