一、罗沙司他
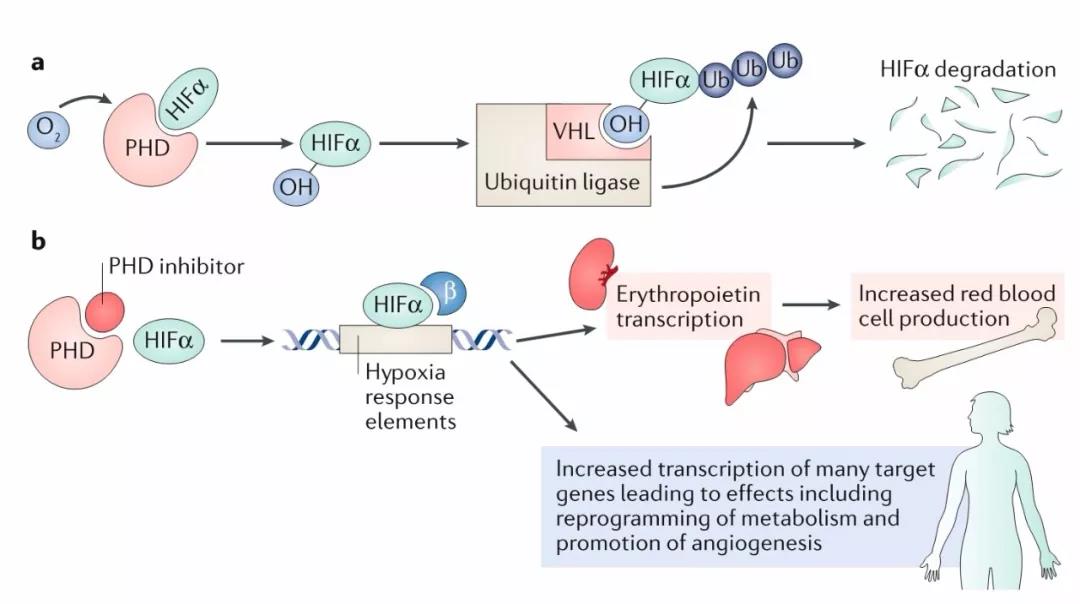
罗沙司他( Roxadustat,FG-4592)胶囊是一种可口服的强效可逆性低氧诱导因子脯氨酰羟化酶抑制剂( HIF-PHI),能够短暂稳定并激活 HIF 转录因子,启动适应性转录反应,从而在含氧量正常的条件下,模拟了在人体低氧环境下才发生的促红细胞的生成反应,包括产生内源性促红细胞生成素以及通过减少铁调素进行铁动员,最终诱导红细胞生成,改善贫血。
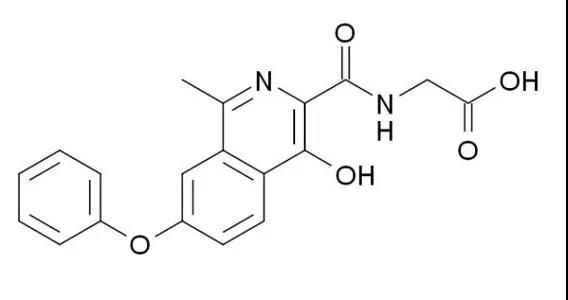
2018年12月,罗沙司他(商品名:爱瑞卓)全球范围内率先在中国获NMPA批准上市,用于慢性肾脏病透析患者的贫血治疗。2019年8月,用于非透析依赖性慢性肾病患者的贫血治疗的适应症获得NMPA批准。2019年11月,罗沙司他通过国家医保谈判纳入医保,价格分别为95.5元/片(50mg)和47.36元/片(20mg)。

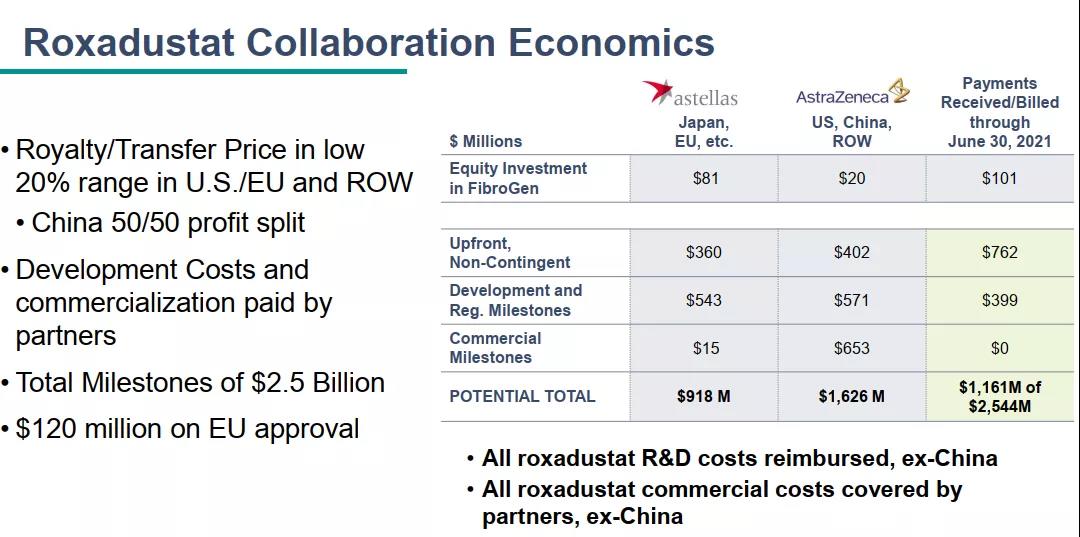
罗沙司他原研为珐博进(FibroGen),阿斯利康(AstraZeneca)和安斯泰来为其全球战略合作伙伴。除中国外,2019年9月已经在日本获批上市,商品名为Evrenzo。韩国、智利也获准上市。本品化合物专利2024年部分到期;晶型专利2033年到期;制剂专利2034年到期。
2021年4月,珐博进(FibroGen)声明:承认为了使数据更有利而改变了用于分析罗沙司他心脏安全数据的标准。
2021年8月11日,珐博进(FibroGen)收到美国FDA关于罗沙司他用于治疗慢性肾性贫血新药申请(NDA)的完整回复函(CRL)。FDA目前不会批准罗沙司他的新药上市申请,并要求FibroGen在再次提交上市申请之前对罗沙司他进行额外的安全性相关临床试验研究。

2021年8月19日,安斯泰来与珐博进(FibroGen)宣布,欧盟委员会 (EC) 已批准 罗沙司他用于治疗与慢性肾病 (CKD) 相关的症状性贫血成人患者。
珐博进(FibroGen) 8 月 9 日发布财务报告显示:罗沙司他2021Q2在中国的净产品收入1340万美元,其中包括向其分销商销售的收入以及珐博进中国的直接销售收入;Q1这部分销售额为 1540 万美元;上半年合计2880万美元。2021年上半年,珐博进和阿斯利康在中国的罗沙司他总净销售额达 9630 万美元。 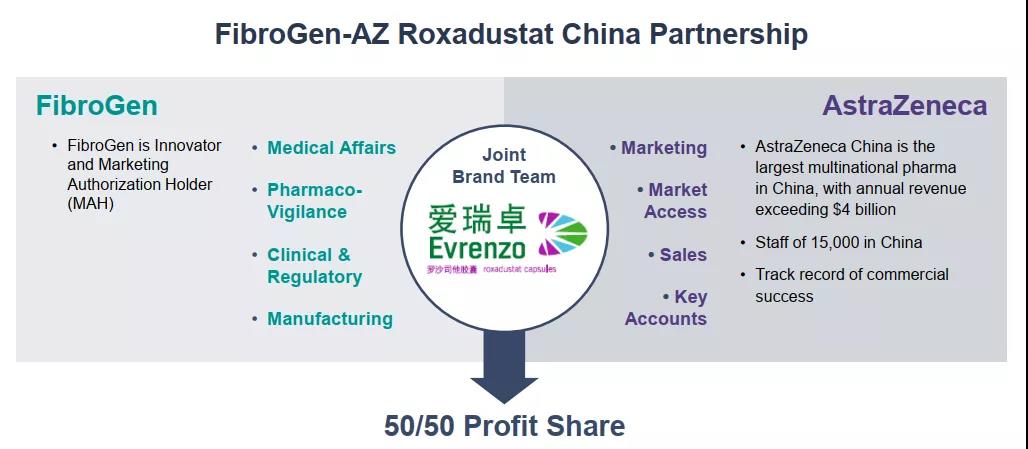
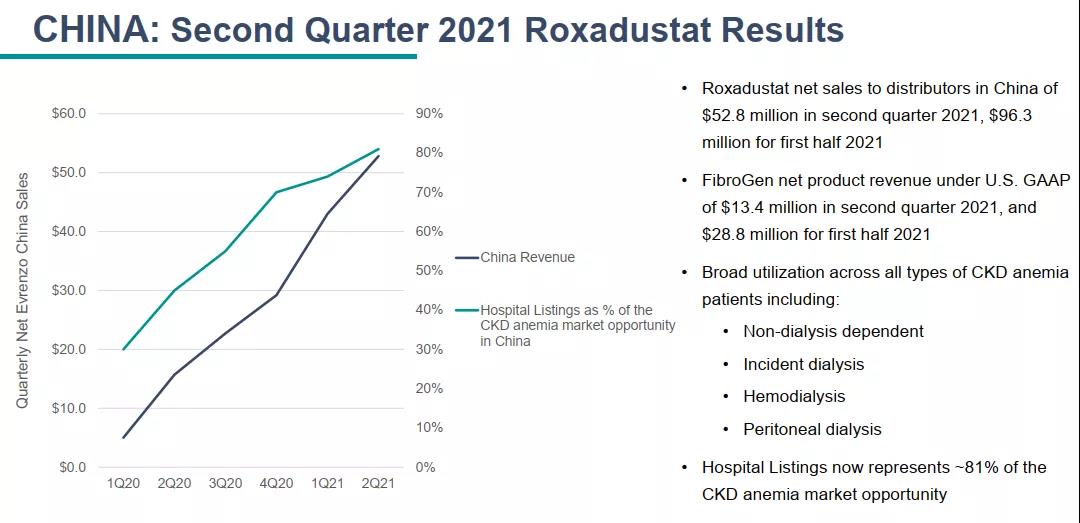

截止2021年6月30日,公司拥有6.45亿美元现金,其中有1.2亿美元的欧洲获批触发的里程碑付款。

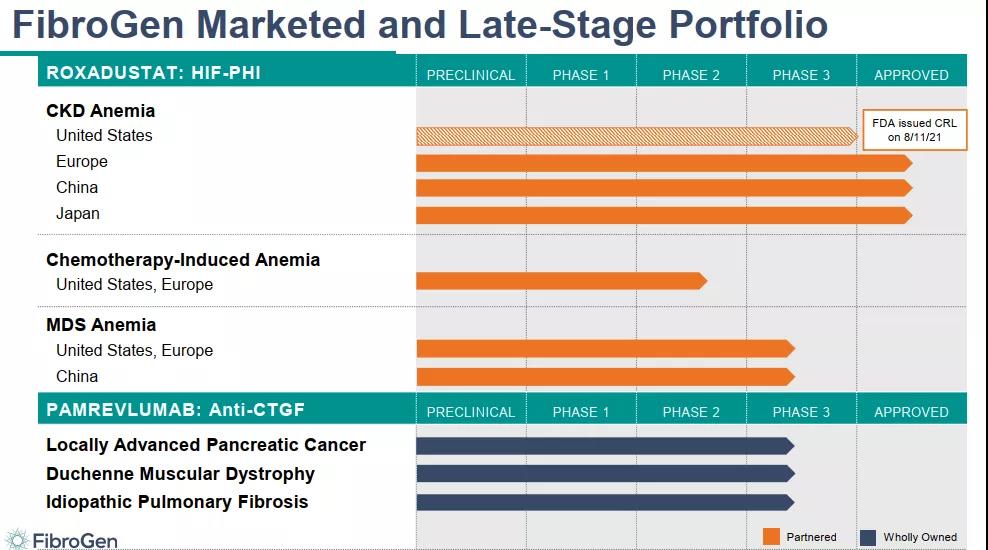
罗沙司他正被开发用于多种类型贫血的治疗:包括骨髓增生异常综合征(MDS)相关贫血、治疗化疗诱导性贫血(CIA)等等。
来自中国的高诚生物(HiFiBiO Therapeutics)是其紧密合作伙伴,合作开发的新药有涉及Galectin-9, CXCR5, CCR8等靶点。
二、CKD
肾性贫血为慢性肾脏病( CKD)肾功能失代偿期主要并发症之一,随着 CKD 的进展, CKD 相关贫血的患病率和严重程度逐渐增加。根据美国和欧洲的数据,预期的贫血率为:血液透析( HD)患者>95%,腹膜透析( PD)患者>80%。透析前, 3 期非透析患者贫血率为 10%,4 期非透析患者贫血率为>50%, 5 期非透析患者贫血率为>75%。
我国约有 9500 万 CKD 患者,每年约 30 万 CKD 患者进展至终末期肾病( ESRD),其中大部分人患有贫血。肾性贫血患者较常规贫血难以纠正,患者乏力严重,生活质量低下。
临床上肾性贫血需积极治疗,肾性贫血的机制为肾的慢性损害,引起肾小管周围间质细胞分泌的促红细胞生成素( EPO)不足、炎症导致的铁吸收和利用障碍共同导致肾性贫血。临床上肾性贫血的标准治疗方法为 EPO 激素替代,阿法依伯汀等红细胞生成刺激剂( ESA)并加静脉铁剂, ESA( rHuEPO)使用标准为当 Hb< 10~11g/dl 时使用,剂量 80~120U/kg,皮下注射 qw。






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论