
5月6日,第十一批国采优化方案第二稿流出。
仅从内容上看,部分争议条款口吻收敛,篇幅大量缩减,具体见文末。
重点提几条(仅供讨论):
1. 过评批文不能随意转让?首轮中选不得换供应商?

此条要求,凡参与集采的过评批文,在由自行生产变更为委托生产时,持有人不得变更。
这条直接针对“A转B”。意味着,自行生产企业可因产能不足新增受托方,但不得通过委托形式将批文转给其他持有人。
此外,首个中标周期内,不得变更生产工艺、原辅包的种类及其供应商。必须要变更的,变更审批同时予以取消中选资格。
这一要求在第十七条再次强调,并明确对低价中选企业及涉及委托生产的持证人将开展专项检查,监管力度进一步加码。

2. 两年制剂经验要求,仅限B证持有人?

第二稿在生产经验要求上作出两点调整:一是适用范围从所有持有人缩小至B证持有人;二是新增放行要求。
这一变化将直接影响企业参采资格。以最近密集过评的洛索洛芬钠凝胶贴膏为例,若按第一稿的要求,除了九典和泰德有两年同剂型生产经验之外,其他企业不论自行生产还是委托生产,均不符经验要求。
而按第二稿,只要不涉及委托生产的A证企业,不再受此限制。除九典、泰德外,哈尔滨力强、武汉法玛星、南京海纳等A证持有人均可直接参与集采。如此,仅B证企业被排除?
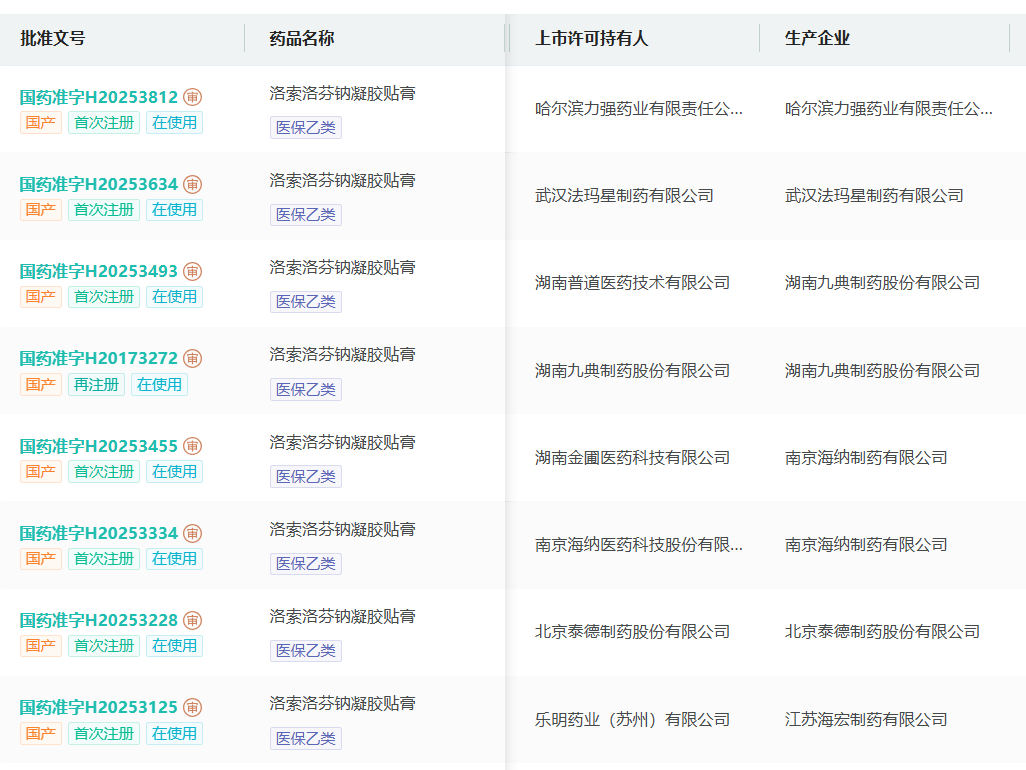
截图来源:摩熵医药数据库
3. 医疗机构按品牌报量,公平吗?

这条是行业最为关注的,引起很大争议。经讨论后,可以明显看出第二稿口吻有所温和,不再强制必须按品牌名报量,但依然坚持保留了医疗机构按品牌名报量的“选择权”。
这一条或许是对于近一段时间关于原研药和仿制药争议的回应,但是这样规则之下,市场竞争是否真的合理、公平?有待探讨。
可以预见的是,一旦医疗机构获得品牌申报选择权,企业将有更大空间进行推广工作,争取更多医院按自家品牌报量,甚至争取更多报量。
这对原本就具备较高覆盖率和市场份额的企业明显有利。
那对于其他“光脚企业”呢?对那些市场基础薄弱、靠低价突围的中小企业来说,低价参与集采,还能换到量吗?
第二稿原文:



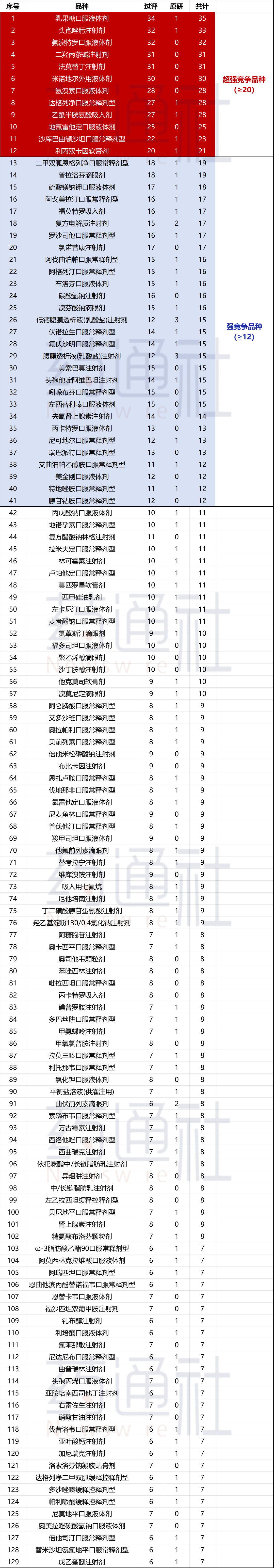
附:符合第十一批国采129个品种竞争格局
想要解锁更多药品信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论