
5月15日,卫材和渤健公司共同宣布,卫材已开始向FDA滚动提交用于每周维持给药的lecanemab-irmb(Leqembi)皮下注射制剂的生物制品许可申请(BLA)。Leqembi静脉注射剂已获批治疗阿尔茨海默病 (AD),适用于轻度认知障碍 (MCI) 或轻度痴呆阶段的患者(统称为早期AD)。

该BLA基于Clarity AD(301研究)开放标签扩展研究(OLE)的数据和观察数据模型。如果获得FDA批准,Leqembi皮下注射剂可用于在家中或医疗机构注射。与静脉注射制剂相比,注射过程所需的时间更短。
作为正在审查的每周360mg皮下注射剂维持治疗方案的一部分,完成两周一次静脉注射起始阶段的患者将每周接受一次剂量,以维持有效的药物浓度,从而持续清除高毒性原纤维,即使在淀粉样β(Aβ)斑块从大脑中清除后,原纤维仍会继续对神经元造成损伤。

截图来源:药融云全球药物研发数据库
Leqembi由卫材和渤健共同研发,2023年1月在FDA快速通道认定下获得批准,用于治疗早期阿尔茨海默病,7月完全获批,成为20年来首款获得FDA完全批准的阿尔茨海默病药物。
Leqembi研发状态(部分)数据
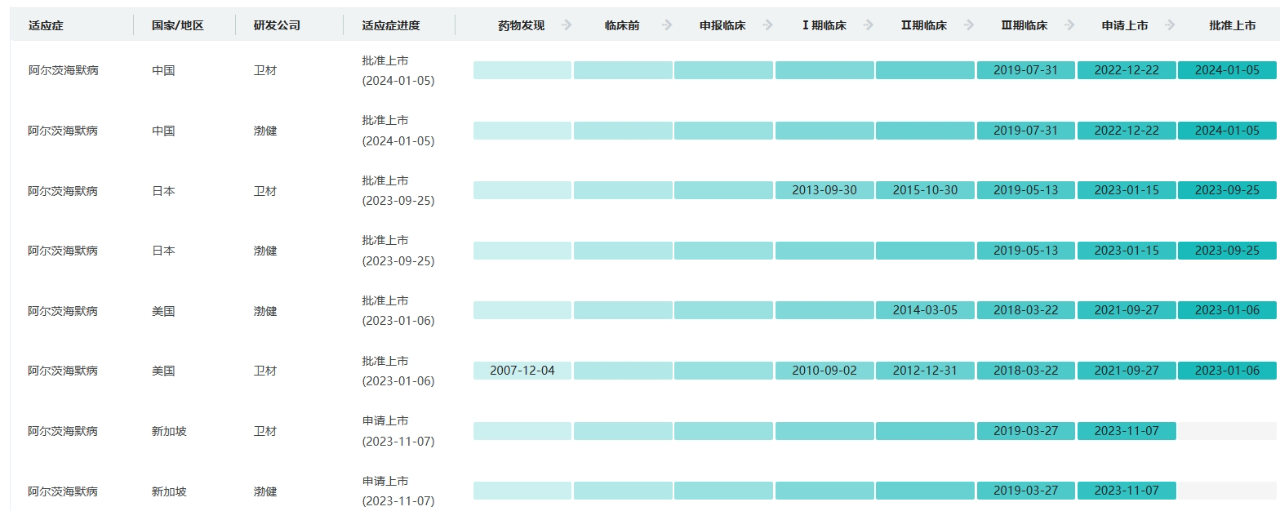
截图来源:药融云全球药物研发数据库
Leqembi目前已在美国、日本和中国获得批准。此外,卫材已于2024年3月向FDA提交了Leqembi每月静脉注射维持剂量的补充生物制品许可申请 (sBLA)。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论