
Cytovia 有资格获得高达 4 亿美元的大中华区授权里程碑许可
协调美国和中国肝细胞癌 GPC3 靶向治疗的临床开发
2021 年 9 月 13 日,佛罗里达州和中国上海,Cytovia Therapeutics, Inc.(“Cytovia”),一家开发同种异体“现成”基因编辑 iNK 和 源自诱导多能干细胞 (iPSC) CAR(嵌合抗原受体)iNK 细胞和 NK 细胞增强多功能抗体的生物制药公司,以及其新成立的专注于中国的合资企业 CytoLynx Therapeutics(“CytoLynx”,再凌生物)宣布已完成 4500 万美元的融资。机构投资者为其管道的 IND 启用和初始临床开发提供资金。
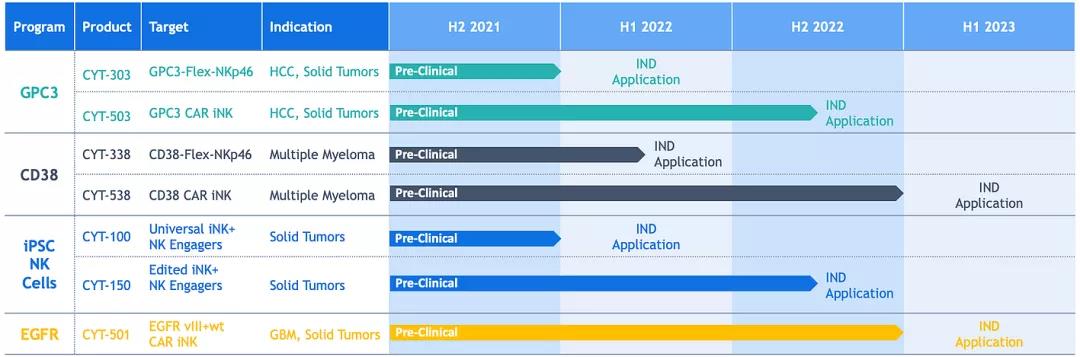
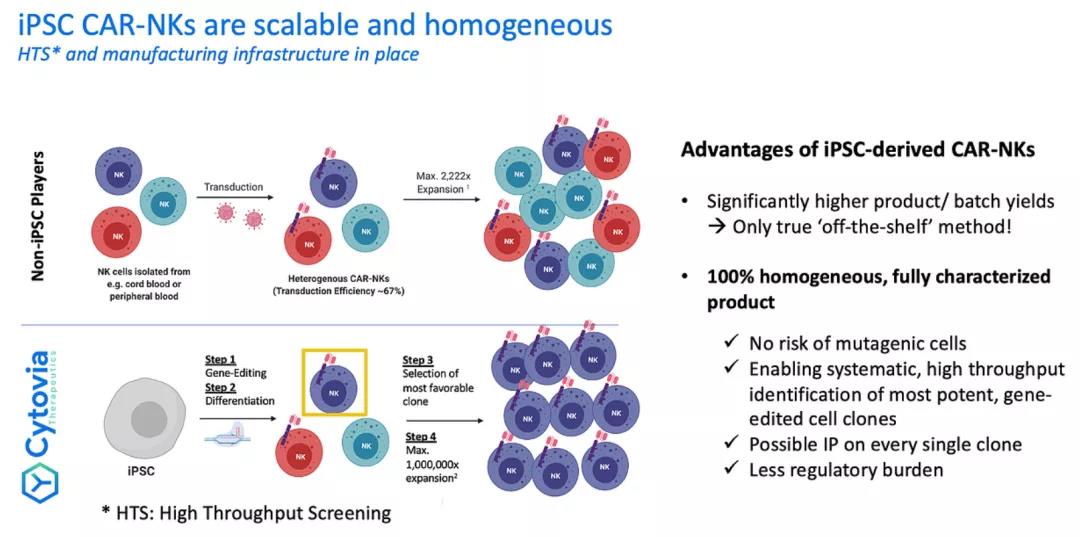
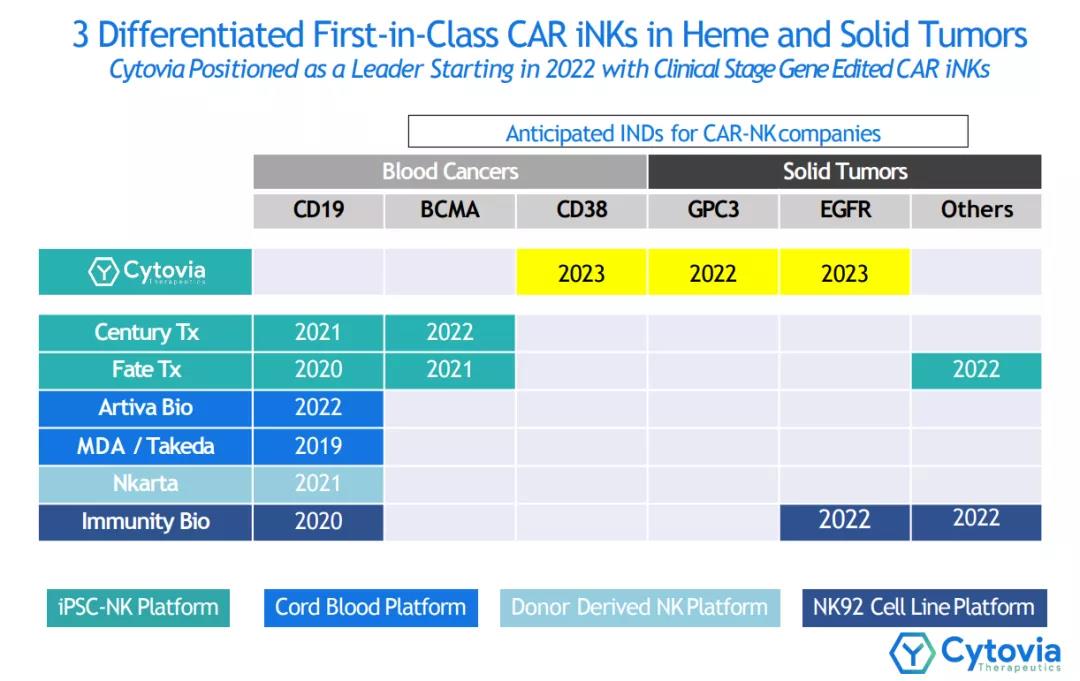
Cytovia Therapeutics 产品线
Cytovia 和中国领先的生物技术机构投资泰福资本成立了 CytoLynx Therapeutics。泰福资本连同云锋基金、博远资本、瑞华资本和 TG Sino-Dragon Fund(由泰格医药支持)已投资 4500 万美元用于支持新企业以及 Cytovia 的研发项目。CytoLynx 和 Cytovia 之间的合作协议将通过大中华地区的产品开发推进多种 NK 疗法。此外,CytoLynx 基于其核心技术获得了 Cytovia 的技术许可,以允许在中国开发其他 NK 疗法以实现全球商业化。根据协议,Cytovia 有资格获得高达 4 亿美元的前期开发和商业里程碑。

Daniel Teper
Cytovia 董事长兼首席执行官 Daniel Teper 博士评论道:“我们很高兴能够加快我们用于治疗肝细胞癌的领先 GPC3 项目的全球开发,这是一种医疗需求未得到满足且亚洲患者人数非常庞大的疾病,尤其是“在中国,并建立一条向中国市场提供这些疗法的途径。CytoLynx 还将作为其他 Cytovia 产品以及获得许可的免疫肿瘤学资产的开发和商业化平台。”
泰福资本董事总经理Wei Cheng博士补充说:“我们很高兴与 Cytovia Therapeutics 合作,为中国患者带来新的治疗选择。Cytovia 拥有经验丰富的创业领导团队和一流的 NK 技术,包括 iPSC-衍生 NK 细胞、基因编辑和 NK Engager 多功能抗体。我们相信,通过结合双方的优势,我们可以使 CytoLynx 和 Cytovia 成为 NK 癌症治疗领域的全球领导者,并使全球患者受益。”
云锋基金执行董事Albert Huang博士表示:“作为本轮融资的领投方,云锋基金认为Cytovia和CytoLynx有能力成为iPSC NK细胞疗法的领军企业。”
关于 Cytovia Therapeutics

Cytovia Therapeutics 旨在加速患者获得转化细胞疗法和免疫疗法的机会,解决癌症中几个最具挑战性的未满足医疗需求。Cytovia 专注于自然杀伤 (NK) 细胞生物学,并将精密工程应用于诱导多能干细胞 (iPSC),以开发安全、有效且广泛可用的现成自然杀伤细胞疗法,作为抗癌的第一道防线。Cytovia 专有的多特异性抗体平台已被定制为在肿瘤部位接合和激活 NK 细胞。这两个平台都为临床医生提供了可选性,也可以协同使用。
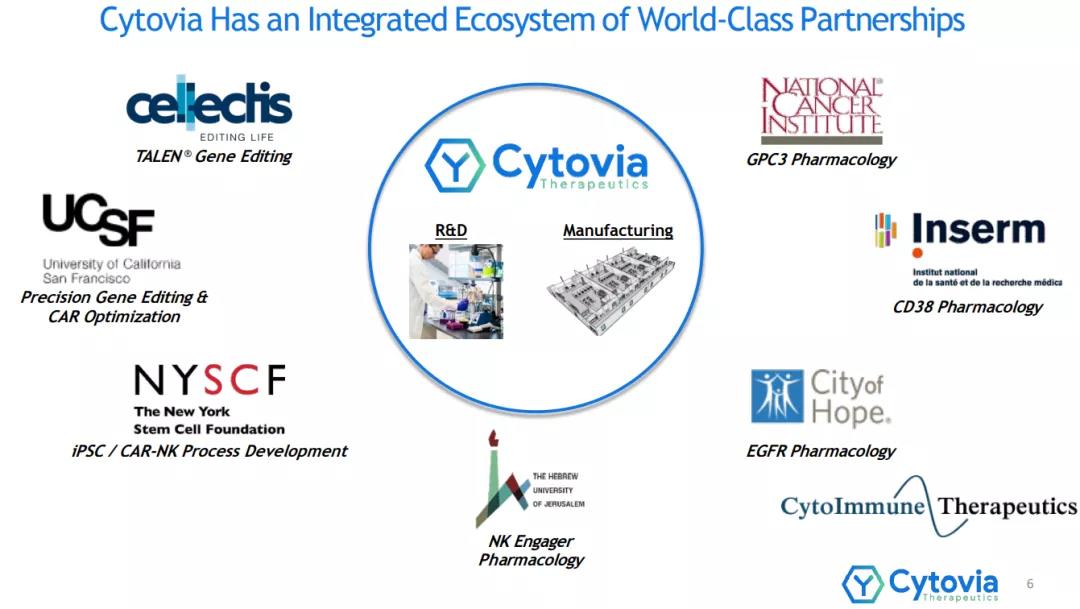
通过与 Cellectis、CytoImmune、耶路撒冷希伯来大学、INSERM、纽约干细胞基金会、STC Biologics 和加州大学旧金山分校的科学合作伙伴关系,Cytovia 位于马萨诸塞州内蒂克的研发实验室和波多黎各的 GMP 细胞制造工厂得到了加强(加州大学旧金山分校)。





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论