
传统药物研发是一场漫长而孤独的赌博。一款新药从实验室的灵光一现到最终摆上药房的货架,平均需要耗费12至15年的光阴,投入超过20亿美元的资金,而成功率却不足10%。科学家们在数以亿计的化合物海洋中“大海捞针”,在复杂的生物体内进行着近乎盲人摸象般的试错。这种基于经验主义和偶然性的研发模式,在21世纪的今天,已然触碰到了效率的天花板。
然而,变革的雷声已至。随着 AI 热潮的再度兴起,人工智能(主要是以 DNN 为核心的深度学习技术)辅助药物发现与设计(AIDD)也成了生物医药领域的研究热点。

“ AI赋能 ”绝非空谈。它在药物研发的各个关键环节都展示出了超越人类直觉的计算能力。 那它究竟解决了哪些具体的痛点?
一、AI在药物靶标发现与确认中的应用
药物研发的第一步,是找到“靶标”——即疾病发生的分子开关。如果把药物比作一把钥匙,靶标就是那把锁。而在人体这个由2万多个基因、数十万种蛋白质构成的巨大迷宫中,找到那把对的锁,无异于大海捞针。AI的介入,为我们提供了全景式的导航图。
1. NLP技术
人类科学家面临的一个巨大痛点是“信息过载”。每天都有成千上万篇生物医学论文发表,海量的知识被淹没在浩如烟海的文本中。
自然语言处理(NLP)技术成为了不知疲倦的“超级阅读者”。
- 实体识别与关系抽取:NLP算法可以扫描PubMed等数据库中的所有文献和专利,精准识别出基因、蛋白质、化合物的名称,并抽取它们之间的动词关系(如“磷酸化”、“抑制”、“上调”)。
- 知识图谱构建:结合DNN技术,AI将这些碎片化的信息拼接成一个庞大的动态知识图谱。通过图算法,AI可以预测出那些在文献中从未直接提及、但逻辑上隐含的潜在靶标-疾病关联。
2. 多组学数据
现代生物学已经进入了“多组学”时代。基因组、转录组、蛋白质组、代谢组数据构成了生命的数字孪生。
AI擅长处理这种高维、高噪音的数据:
- 差异分析:通过对比患者与健康人的多组学数据,AI利用机器学习(如随机森林、XGBoost)识别出关键的差异表达分子。
- 网络药理学:AI分析生物网络(信号转导网络、代谢反应网络、PPI网络),寻找那些处于网络枢纽位置(Hub)的关键蛋白。攻击这些枢纽往往能起到牵一发而动全身的治疗效果。
3. 高内涵筛选与计算机视觉
除了数字,图像也是重要的信息载体。基于高内涵筛选(High-Content Screening, HCS)和显微成像技术,细胞的形态变化往往预示着药物的作用机理。
深度学习中的卷积神经网络(CNN)具备超人的视觉能力。它能察觉到人类肉眼无法分辨的细微形态变化——比如线粒体的轻微肿胀、细胞骨架的微小重排或染色质纹理的改变。
表型筛选:AI将细胞图像转化为高维特征向量,通过聚类分析,发现具有相似表型效应的基因或化合物,从而推断潜在靶标的功能。这种方法被称为“图像组学”或“细胞绘画”。
4. 结合亲和力的精准预测
在确定了潜在靶标后,还需要验证小分子是否能与其结合。
传统的分子对接计算量大且准确率有限。AI模型(如DeepDTA, GraphDTA)将蛋白质序列或结构与小分子结构作为输入,视为一种“翻译”问题或“图像匹配”问题,直接预测两者的结合亲和力。这大大加速了靶标验证的过程。
二、AI在先导化合物发现中的应用
一旦锁定了靶标,下一步就是寻找能结合这把锁的钥匙——先导化合物。这一阶段,AI正引领着从“筛选”到“生成”的革命性转变。先导化合物发现的手段主要有高通量筛选、虚拟筛选(包括分子对接、分子间相互作用预测、成药性参数预测)、药物重定向和基于片段的药物筛选。
1. 虚拟筛选
传统的高通量筛选(HTS)需要在实验室中利用自动化机械臂测试数百万个实体化合物,耗资巨大,且受限于实体库的规模(通常在106数量级)。
AI驱动的虚拟筛选将这一战场转移到了计算机中。
- 超大规模库筛选:AI模型可以在包含数十亿甚至数千亿分子的虚拟库(如Enamine REAL Space)中进行快速搜索。
- 药效团匹配与形状搜索:AI不仅仅看化学结构,更看分子的3D形状和静电势分布,寻找与靶点口袋完美互补的分子。
- 案例:在2020年新冠疫情初期,BenevolentAI利用其知识图谱和虚拟筛选技术,在短短几天内就筛选出巴瑞替尼(Baricitinib)可能有效,后经临床证实并获批,这在传统研发中是不可想象的。当然,AI擅长发现科学上的关联,而药物的商业再生则需要市场数据的支撑。在AI筛选出老药候选名单后,借助摩熵数据的上市药物及一致性评价板块,快速评估其原研专利状态及仿制药竞争格局,能帮助决策者迅速判断:这究竟是一个值得投入的“新机会”,还是一片无利可图的“红海”。
2. 从头设计(De Novo Design)
我们正处于AI最令人心潮澎湃的变革前沿。传统的药物发现长期受限于“筛选”模式——即在有限的已知分子库中试图找出符合要求的化合物,如同在大海中捞针。然而,人工智能与计算化学的深度融合,彻底颠覆了这一逻辑,催生了“从头设计”(De Novo Design)的新纪元。
这一飞跃的核心驱动力,源自生成式AI(Generative AI)技术的爆发式增长。从早期的变分自编码器(VAE)到生成对抗网络(GANs),再到如今备受瞩目的扩散模型(Diffusion Models),这些算法赋予了计算机理解并重构化学结构的能力。它们不仅仅是在预测性质或结合力(传统AI的角色),而是致力于在广阔化学空间中进行导航与绘制,打破了现有类药数据库的边界。
从头分子设计主要采用两种策略。
整体生成:从零开始构建分子的完整拓扑结构。这不仅是寻找新药的利器,更是探索未知化学版图的指南针,特别适用于缺乏先例的早期发现阶段。
迭代生成:以逐步添加原子或片段的方式构建分子。这种策略具备极高的可控性,能够针对特定生物靶点或材料性能要求,对分子进行精准的定向优化与定制。
案例:Insilico Medicine的突破
一个标志性的案例是Insilico Medicine。他们利用生成式AI平台Chemistry42,针对特发性肺纤维化(IPF)这一难治疾病,发现了一个全新的靶点,并设计出了一款全新的候选药物ISM001_055。从靶点发现到提名临床前候选化合物,仅用时18个月,花费260万美元,而传统方式通常需要4-5年和数亿美元。这一成果于2024-2025年间在Nature Medicine等顶级期刊发表,并进入了二期临床试验,成为了AI制药的里程碑。

图源:摩熵医药数据库
3. 合成路线的同步规划
药物化学中有一个经典难题:“设计得出,造不出”。很多AI生成的分子结构极其复杂,难以合成。
现在的AI在设计分子的同时,会同步运行逆向合成预测算法(如MIT开发的ASKCOS或IBM的RXN)。它像一个经验丰富的老合成师,瞬间规划出从廉价原料到目标分子的合成路径,并预测每一步的反应条件和产率。这确保了AI设计的分子不仅好看,而且好做。
三、AI在先导化合物优化中的应用
找到先导化合物只是开始,它往往像一块璞玉,活性虽好,但可能毒性大、代谢快或溶解度差。将璞玉雕琢成美玉的过程,称为先导化合物优化。这是一个在多个相互冲突的目标中寻找平衡的艺术。
1. 数据增强与小样本学习的奇迹
先导化合物优化面临的最大挑战是“小数据”。对于一个新的骨架,往往只有几十个衍生物的活性数据。深度学习通常是“数据饥渴”的,但在药物化学中,我们往往面临数据贫乏的困境。
AI通过迁移学习和数据增强技术破局。
- 迁移学习:模型先在包含数百万个分子的通用数据库(如ChEMBL)上进行预训练,学习化学键、官能团等基本“语法”规则。然后,再用那几十个特定的先导化合物数据进行微调。这就像让一个博学的语言学家去学习一门新的方言,远比从头学起要快得多。
- 低样本学习:结合元学习算法,AI能从极少量样本中快速捕捉构效关系(SAR)。
2. 多目标优化的帕累托前沿
一个完美的药物,必须同时满足一系列严苛的条件:高活性(Potency)、高选择性(Selectivity)、良好的吸收(Absorption)、合理的分布(Distribution)、适度的代谢(Metabolism)、有效的排泄(Excretion)和低毒性(Toxicity)。这就是著名的ADMET性质。
这往往是一个“按下葫芦浮起瓢”的跷跷板游戏:为了提高活性增加疏水性,可能会导致溶解度下降;为了增加代谢稳定性引入卤素,可能会增加分子量。
AI模型(如多任务图神经网络)可以同时预测几十种ADMET参数。通过多目标优化算法,AI能在这些相互冲突的目标中找到帕累托最优解(Pareto Optimality),引导化学家设计出综合性能最优的分子,而不是只有单一指标突出的“偏科生”。
3. 靶点垂钓与脱靶效应预测
药物进入体内后,除了结合目标靶点,还可能错误地结合其他蛋白,导致严重的副作用(脱靶效应)。例如,如果药物意外结合了hERG钾离子通道,可能会导致心脏骤停。
AI通过靶点垂钓(Target Fishing)技术,反向预测一个分子可能结合的所有潜在靶标。这不仅有助于在早期规避毒性风险,有时还能带来意外之喜——发现老药的新用途(药物重定向),即“老药新用”。
四、AI在临床试验设计中的应用
临床试验是新药研发中最昂贵、耗时最长、失败率最高的环节,被称为“死亡之谷”。统计数据显示,大约只有10%进入临床的药物最终能获批上市。一旦在三期临床失败,意味着数十亿美元的投入打水漂。AI正在努力填平这座深谷。
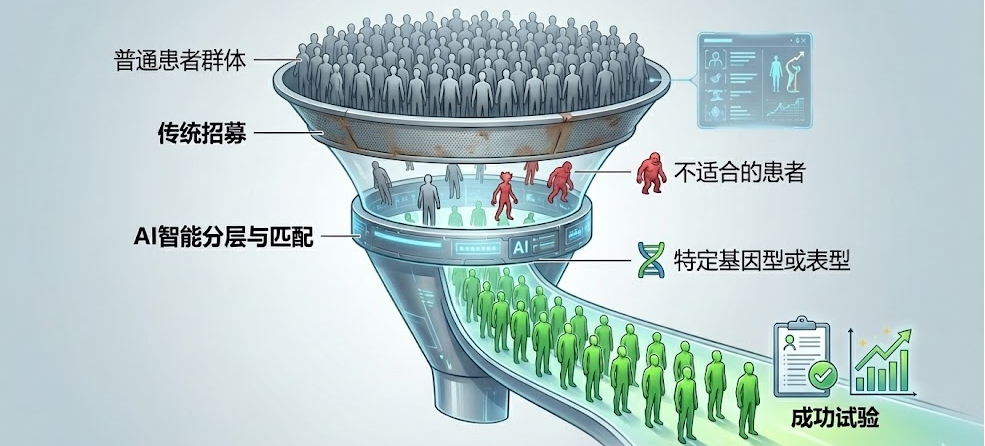
1. 智能招募
临床试验失败的一个主要原因(约占30%)是无法招募到足够数量的合适患者。传统的招募方式依赖医生推荐和广告,效率极低。
- 电子健康记录(EHR)挖掘:利用NLP技术,AI可以扫描医院系统中数以万计的非结构化病历,精准定位符合入排标准(Inclusion/Exclusion Criteria)的患者。
- 精准匹配:AI不仅看年龄、性别,还深入分析遗传数据和生物标志物,筛选出对药物最可能有响应的特定亚群患者。这不仅加快了招募速度,更大大提高了试验成功的概率。
- 案例:TrialX等公司利用AI技术,通过分析搜索行为和地理位置,实现了临床试验的“超个性化”推荐,解决了患者“找不到试验”和试验“找不到人”的双向盲区。
2. 试验设计的沙盘推演与模拟
传统的临床试验设计往往依赖经验,一旦开始就难以更改。而AI可以通过分析历史临床数据,进行模拟临床试验。
在真实患者入组前,AI就可以模拟不同的给药方案、样本量、终点指标,预测不同设计方案的成功率。这就像在战争发动前进行的沙盘推演,帮助决策者选择胜算最大的战术,避免因设计缺陷导致的无谓失败。
3. 实时监测与数字孪生
在试验进行中,AI结合可穿戴设备,实现了对受试者7x24小时的实时守护。
DNN算法实时分析心率、血压、睡眠等连续生理数据,不仅能比医生更早发现潜在的严重不良事件(SAE),还能监测患者是否按时服药,保证数据的质量。
更为激进的创新是数字孪生(Digital Twin)和合成对照臂(Synthetic Control Arms)技术的应用。在某些罕见病或致死性疾病的试验中,招募对照组(服用安慰剂)既困难又不道德。AI可以基于历史真实世界数据(RWE),生成一组虚拟的对照组患者数据。这不仅解决了伦理难题,还显著降低了试验成本和周期。
4. 拯救失败的试验
甚至在试验失败后,AI也能发挥作用。通过对失败试验的数据进行深度挖掘,AI有时能发现药物在某个特定亚群中其实是有效的。
案例:一个著名的例子是针对阿尔茨海默病的药物。虽然总体试验失败,但AI分析发现,在疾病进展较慢的患者亚群中,药物显示出了显著疗效。这为药物的“起死回生”提供了关键线索。
结语
我们正处于药物研发范式重构的关键时刻。AI 技术的演进,正在把药物发现从一项充满不确定性的“试错艺术”,转化为如芯片设计般严谨的“精密工程”。
未来的核心竞争力在于构建实验室闭环(Lab-in-the-Loop)。通过计算模拟(干实验)与自动化生物验证(湿实验)的实时交互,AI 模型在数据的滋养下不断自我进化,极大地提升了研发的精度与效率。
当然,技术狂奔的同时不能忽视数据隐私与伦理边界。我们需要建立更加透明、负责任的 AI 体系。归根结底,科技的终极价值在于服务人类福祉。在人类直觉与机器算力的双重驱动下,我们离攻克顽疾、解码生命的终极目标从未如此接近。
扩展阅读:
1. 2024 AI助力药物临床前研发:最新技术、国内企业竞争格局分析
2. 2024年人工智能(AI)制药行业概览丨行业演变、政策导向与资本趋势
3. 【深度】AI+制药赋能全产业链,药企“弯道超车”新机遇!
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论