
原辅料相容性试验是研究非活性成分在产品质量中的作用的一个重要组成部分。 对用于相容性研究的辅料的选择,应该基于对原料药及其杂质、辅料及其杂质、降解途径和药品生产可能采用的工艺条件的系统理解[1](《创新药研发的原辅料相容性的一些考虑》)。
原辅料相容性实验设计的目的是判断原料药和辅料之间是否会发生化学反应,试验设计要紧紧围绕这点。原辅料相容性实验设计并无固定标准,目前常用的指导原则有4种。
1.QbD指导原则[1]
QbD指导原则中原料药与辅料的比例均为1:1,混合形成二元混合物,在25℃/60%RH和40℃/75%RH条件下,分别在敞口和密闭容器中放置一个月。
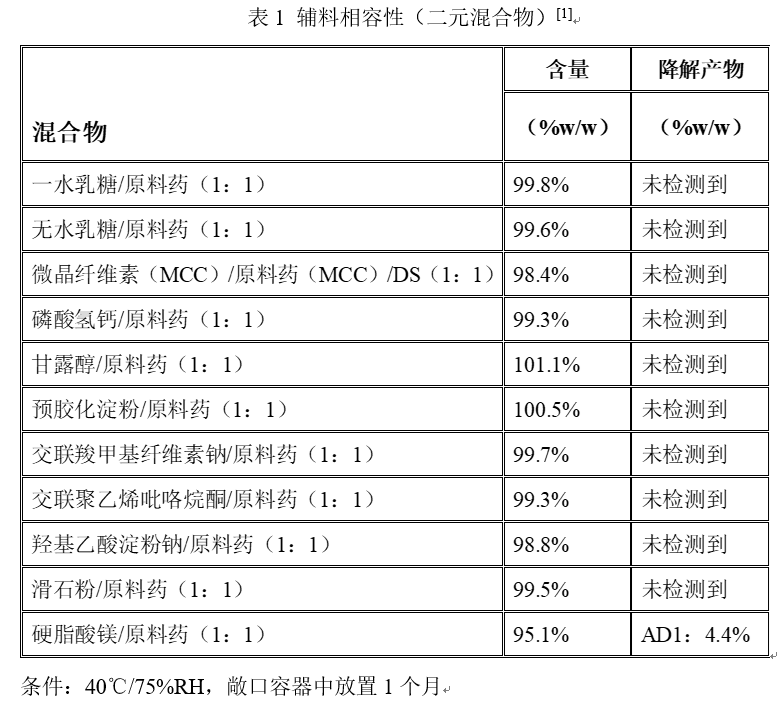
2.《化学药物制剂研究基本技术指导原则》[2]
化学药物制剂研究基本技术指导原则确定了原料药与辅料的比例:辅料用量较大的(如稀释剂等),可按原料药:辅料=1:5的比例混合,若用量较小的(如润滑剂等),可按原料药:辅料=20:1的比例混合,但何为用量较大,用量较小,并无明确的比例规定,相容性研究具体内容如下:

3.原辅料相容性试验标准操作规程[3]
3.1原辅料相容性试验-针对国内申报项目

3.2原辅料相容性试验-针对国外申报项目

4.ICH[4]
原辅料相容性研究在ICH 药品研发Q8(R2)2.1.2 Excipients部分中也有明确要求(第3页),具体内容如下:
辅料
申报者应针对各种辅料的作用,详述其选择过程,配比以及可能影响的药物制剂性能(如稳定性、生物利用度)或可生产性。处方中应包括药物制剂生产中所用到的所有物质,不论其是否出现在成品中(如:工艺辅助剂)。必要时,应建立辅料之间的相容性(比如双重防腐系统中防腐剂的组合)。同时,应阐述辅料(如抗氧剂、渗透促进剂、崩解剂、控释剂)是否能实现预期的作用,是否能在预期的有效期内发挥作用。可能的情况下,可以利用有关辅料性能的资料,来论证辅料的选择和质量属性,并支持证明药物制剂质量标准的合理性(3.2.P.5.6)。
有关辅料安全性方面的资料,可以被交叉引用(3.2.P.4.6)。
综上所述,目前尚无统一的原辅料相容性试验设计指南,因此在设计原辅料相容性试验时应充分考虑原料药、辅料的理化性质。
5.实验考虑
5.1辅料种类与比例
仿制药开发过程中,原研品辅料种类基本都能查询到,按照原研品辅料种类做实验即可。但是辅料用量大多不能查到,当不确定辅料用量时,实验设计可根据原料药占比来确定原料药和辅料的比例。例如,原料药占20%,辅料最多是80%,原料药:辅料=1:8;原料药占50%,辅料最多是50%,原料药:辅料=1:1;也可参考以上四种指导原则。
5.2实验条件
原辅料相容性实验条件设计可参考以上四种指导原则或2020版中国药典9001《原料药物与制剂稳定性试验指导原则》。虽然实验条件多是在高温、高湿和强光条件下,但具体药物具体分析,并不需要三种条件都做。例如,在已知原料药光不稳定的基础上,要取消强光条件,并对样品避光处理。主辅料相容性实验设计的目的是判断原料药和辅料是否会发生化学反应,高温、高湿和强光条件仅是来加速化学反应发生的速度。
5.3实验指标
原辅料相容性的实验指标一般包括:物理外观、含量、有关杂质、水分等。除此之外,根据原料药的性质必要时可以设计其他试验,比如考察pH值、晶型、熔点等。在一般原辅料相容性试验中,物理外观、含量、有关杂质、水分均需测定。样品含量的测定存在一定争议。有些人认为样品吸湿会导致含量下降,从而影响结果的判断;有些人认为含量是样品的重要控制指标,在分析验证方法无法对所有潜在杂质监控时,含量是重要佐证。笔者认为,吸湿问题可通过控制室内湿度和单独称样来避免,含量需要测定。
5.4实验结果
由于原辅料相容性实验样品众多,也常常出现异常数据。例如数据忽上忽下,造成这种数据的主要原因是样品没有混匀,所以不同取样时间的数据呈锯齿状。故原辅料相容性试验数据看趋势变化。同时,实验数据呈现趋势性下降,首先要排除原料药的影响,若原料药在剧烈条件下也发生降解,则不是原料药和辅料的问题。再排除原料药影响的基础上,含量下降多少,有关物质增加多少可以认定两者不相容呢,这并没有固定的标准。一般有关物质增加3%,含量下降3%以上,就可以说明原料药和辅料不相容。
6.总结
原辅料相容性实验的原辅料配比、实验条件并不能完全模拟制剂产品的生产过程,故实验数据显示原料药和辅料存在不相容问题,但并不影响产品开发继续使用该辅料。例如,硬脂酸镁与原料药发生反应生成新的化合物,在已知原料药和除硬脂酸镁以外的所有辅料并无相互作用的基础上,制剂研究者采用硬脂酸镁外加来减少和原料药的接触,所得样品杂质低于未知杂质的限量,稳定性良好。
注意:原辅料相容性实验结果提示原料药和辅料不相容并不代表该辅料一定不能用。实验结果仅是为制剂研究者提示某些辅料和原料药存在相容性风险,至于辅料能不能用需要综合考虑。
[1] “质量源于设计” 理念应用于仿制药申报(ANDA)速释制剂示例.
[2] 化学药物制剂研究基本技术指导原则.
[3] 原辅料相容性实验的标准操作规程.
[4] 药物原辅料相容性研究要求、不相容情形及筛选试验.嘉峪监测网。
<END>




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论