导读:
- 5月17日-5月23日,CDE新公示临床试验共计56项
- 从药品类型来看,化学药物共计43项,生物制品12项,中药/天然药物1项
- 从临床分期来看,临床I期17项,临床II期4项,临床III期10项
- 从实验状态来看,56项试验均在进行中
- BE试验24项,涉及感染、肿瘤和精神系统疾病等多个适应症,他达拉非片开展最多,康迪沙药业集团有限公司以2项BE试验位列申办企业首位
- 国内外新药试验32项,进口药试验多处于临床后期,涉及罗氏、辉瑞等企业,国内企业中恒瑞以5项登记试验位列第一
5月17日-5月23日CDE新公示临床试验概览
2021年5月17日-5月23日,CDE新公示临床试验共计56项。从药品类型来看,化学药物共计43项,生物制品12项,中药/天然药物1项。
5月17日-5月23日新公示临床试验药品分类
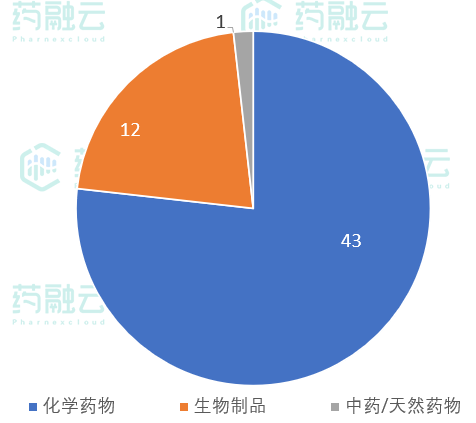
数据来源:药融云中国临床试验数据库
从临床分期来看,临床I期17项,临床II期4项,临床III期10项,没有试验进入临床IV期,其他试验25项(主要是BE试验)。
5月17日-5月23日新公示临床试验分期
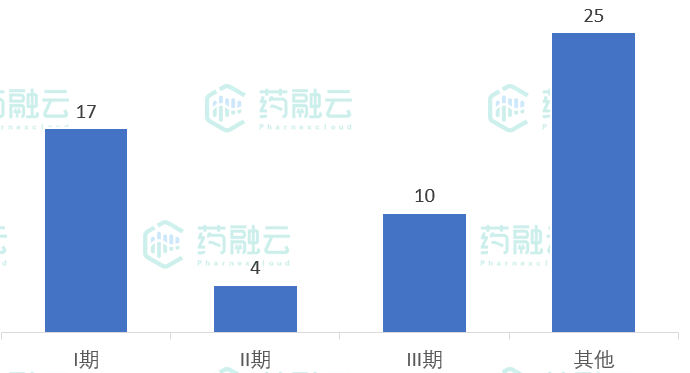
数据来源:药融云中国临床试验数据库
从实验状态来看,56项试验均在进行中,其中54项尚未开始招募,2项试验正在招募中。
5月17日-5月23日公示临床试验状态
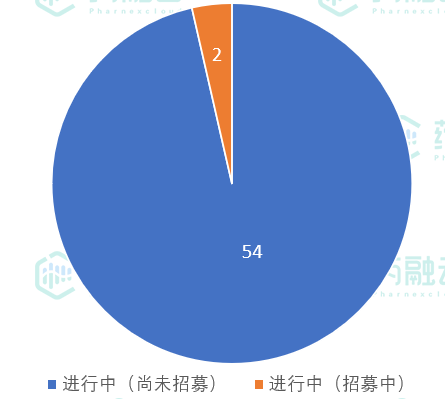
数据来源:药融云中国临床试验数据库
新公示24项BE试验,
他达拉非片开展BE试验最多
5月17日-5月23日公示BE试验24项,涉及感染、肿瘤和精神系统疾病等多个适应症。从试验药品来看,他达拉非片开展最多,共开展2项BE试验。从申办药企来看,康迪沙药业集团有限公司以2项BE试验位列第一。
5月17日-5月23日新公示BE试验汇总

数据来源:药融云中国临床试验数据库
进口药试验基本处于临床后期,
国内新药试验中恒瑞以5项试验位列第一
新公示进口药试验6项,其中5项处于临床III期,包括肝癌、肺癌等适应症,涉及罗氏、辉瑞等企业。国内新药试验共26项,包括肿瘤、糖尿病等适应症,恒瑞以5项登记试验位列第一。
5月17日-5月23日新公示进口药试验汇总
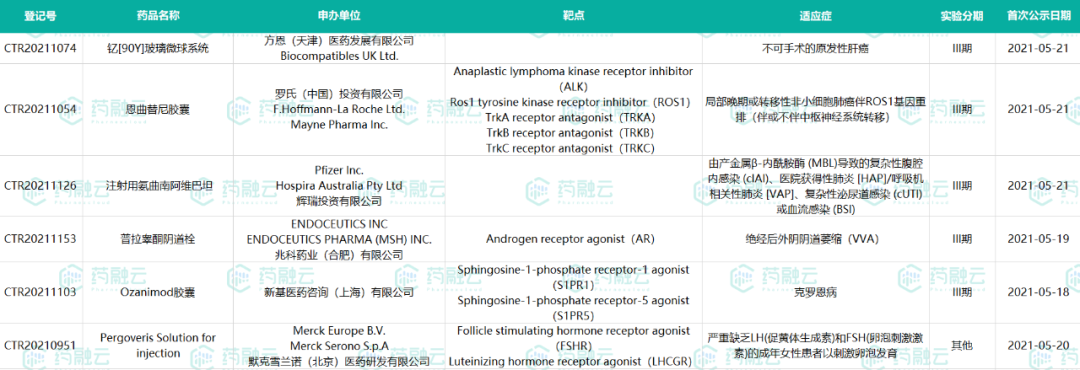
数据来源:药融云中国临床试验数据库
5月17日-5月23日新公示国内新药试验汇总
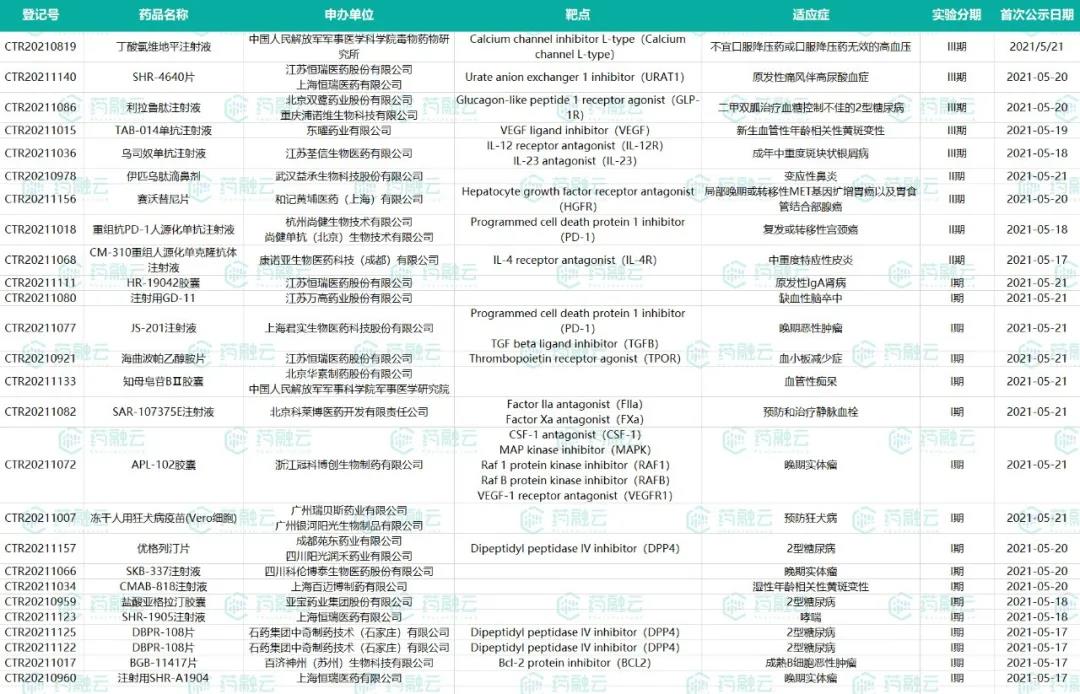
数据来源:药融云中国临床试验数据库
5款重点新药介绍,
涉及罗氏、恒瑞、君实等企业
恩曲替尼胶囊
申报企业:罗氏
恩曲替尼是一种新型抗癌药物,是全球第三款“广谱”抗癌药,用于治疗12岁及以上的儿童和成人患者的神经营养性酪氨酸受体激酶(NTRK)融合阳性的实体瘤和ROS1阳性转移非小细胞肺癌。2019年6月恩曲替尼在日本上市,2019年8月,恩曲替尼经FDA批准在美国上市。目前,国内恩曲替尼临床试验正在进行中。
SHR-4640片
申报企业:恒瑞
SHR-4640片属于新一代URAT1选择性抑制剂,是恒瑞医药自主创新的1.1类抗痛风药物,主要用于高尿酸血症和痛风的治疗。初步试验结果显示,单次给予20mg剂量,多次给予10mg剂量下耐受性良好,没有出现严重的不良事件。连续7天给药,尿酸下降约20%-55%。
乌司奴单抗注射液
申报企业:荃信生物
乌司奴单抗由美国强生公司研发,于2009年9月获得FDA批准,适应症为中度至重度斑块状银屑病、活跃的银屑病性关节炎、克罗恩氏病和中度至严重活动性溃疡性结肠炎。乌司奴单抗在全球拥有超过十年临床使用数据,其长疗效、安全、低复发的特点已经过大量临床研究证明。在临床和患者用药反馈中,有过生物制剂使用史的患者在接受乌司奴单抗治疗后,仅在短短的两个月内,其应答率较之初次使用生物制剂者甚至更高一点,而在四个月后此类患者的应答率高达80%。2019年5月,国家药监局和国家卫健委将乌司奴单抗(喜达诺®)纳入到第二批临床急需境外新药名单中。目前乌司奴单抗尚未有国产药品,皆为进口药品,华东医药和荃信生物合作研发的生物类似药乌司奴单抗注射液在国内临床进展领先,未来有望打破乌司奴单抗自2009年上市以来只有单一品种在全球市场销售的局面。
JS-201注射液
申报企业:君实生物
JS-201是君实生物自主研发的能同时靶向PD-1和TGF-β(转化生长因子-β)的双功能融合蛋白,用于晚期恶性肿瘤的治疗。肿瘤微环境中PD-1和TGF-β通常会同时高表达,TGF-β是免疫抑制的重要驱动因素,进而介导抗PD-1单抗的原发性耐药,且同时阻断PD-1和TGF-β两个免疫抑制信号可产生协同作用。JS-201可有效阻断PD-1/PD-L1和TGF-β免疫抑制通路,改善肿瘤微环境中的免疫调节作用,从而促进人体免疫系统对于肿瘤细胞的杀伤作用,有效增强免疫应答,减少免疫逃逸及耐药性的发生。
BGB-11417片
申报企业:百济神州
BGB-11417是百济神州自主研发的一款Bcl-2抑制剂,具有高选择性。在有些血癌和其它肿瘤类型中,Bcl-2蛋白的积累会导致肿瘤细胞无法进入细胞凋亡过程。Bcl-2抑制剂可以通过选择性抑制Bcl-2蛋白来恢复肿瘤细胞程序性死亡机制(细胞凋亡),从而杀死肿瘤。根据百济神州早前发布的公开资料,BGB-11417是一款潜在“best-in-class”新药,已在血液肿瘤模型中展示出了抗肿瘤活性,并具有一定潜在优势,包括:有望克服耐药性;如有需要,可提高剂量用于实体瘤适应症;对Bcl-2的选择性相对于Bcl-xL更高;在动物GLP毒理研究中,NOAEL(未观察到有害作用水平)暴露量比预期的人体治疗暴露量高出近30倍;很容易与百济神州开发的BTK抑制剂泽布替尼联合使用;在生化和细胞分析中,BGB-11417表现出较强的疗效和选择性。

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论