正式商业推出并上市
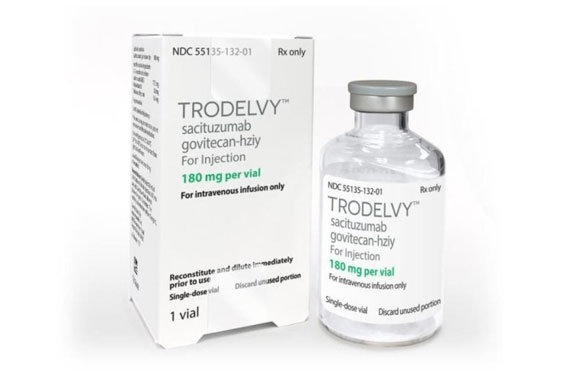
药融云数据库显示:2022年6月7日,中国国家药品监督管理局(NMPA)批准拓达维®(英文商品名Trodelvy®,戈沙妥珠单抗)(SG,Sacituzumab Govitecan)用于既往至少接受过2种系统治疗(其中至少一种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌(TNBC)成人患者。批准文号:国药准字SJ20220015。
时隔一年之后,戈沙妥珠单抗于2023年6月13日开始商业供货,正式登陆中国临床实践,为中国晚期三阴性乳腺癌(TNBC)患者带来强有力的新型治疗选择。
本次NMPA获批依据:Ⅲ期ASCENT研究显示,接受过≥2线标准化疗的转移性三阴性乳腺癌,戈沙妥珠单抗组对比医生选择的化疗方案,中位无疾病进展生存(PFS)分别是5.6个月 vs 1.7个月,中位总生存(OS)分别为12.1个月 vs 6.7个月,客观缓解率(ORR)分别为35%和5%,中位缓解持续时间(DOR)分别为6.3个月和3.6个月。基于该研究数据,戈沙妥珠单抗于2021年4月获得美国FDA完全批准,用于既往接受过至少两种系统治疗,其中至少一种为针对转移性疾病的治疗的不可切除的局部晚期或转移性TNBC患者。在中国的注册临床研究中,戈沙妥珠单抗ORR达到38.8%,疗效与安全性与以往研究结果相似。据药融云数据库查询,监测价格:规格为180mg/瓶的售价为8400元人民币。
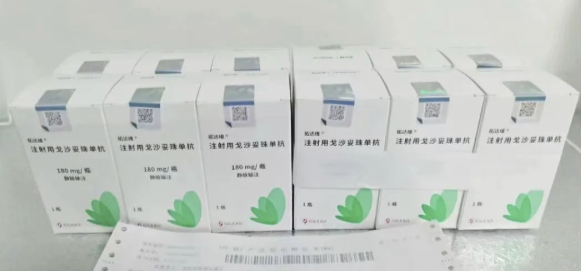
首次获批的Trop-2 ADC
Trop-2为人滋养细胞表面糖蛋白抗原2,其膜内结构域可以通过磷酸化介导多种信号通路,在肿瘤细胞增殖、分化和转移中扮演重要角色。并且Trop-2的过表达与实体瘤患者的不良预后显著相关。在TNBC中有88%患者为Trop-2中高表达,在正常组织中表达有限。此外,Trop-2还能介导抗Trop-2抗体的内吞作用。
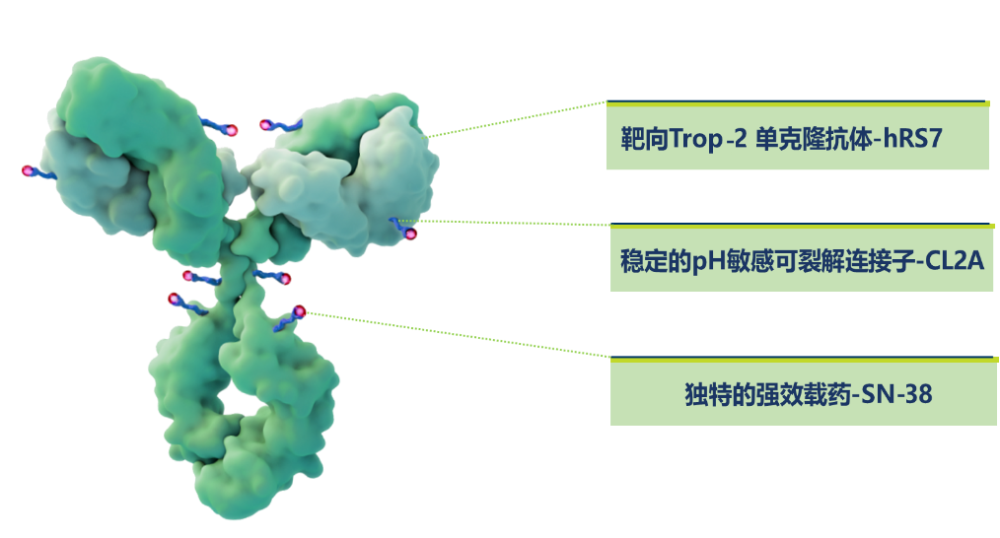
戈沙妥珠单抗采用PH敏感性的可裂解连接子CL2A,连接部位对pH条件敏感,在循环系统中不易水解,而在肿瘤细胞溶酶体内或肿瘤微环境的酸性环境中可发生水解,释放的SN-38可渗透进入临近肿瘤细胞发挥旁观者效应。此外,CL2A在结构上引入了聚乙二醇(PEG)亲水基团,能增加连接子的亲水性,改善ADC溶解性。并且戈沙妥珠单抗采用半胱氨酸偶联,偶联位点最多为8,因而所得产物异质性较小,均一性更高。
戈沙妥珠单抗的载药毒素SN-38是伊立替康的活性代谢产物,主要通过抑制拓扑异构酶Ⅰ阻止DNA的复制和转录,与乳腺癌常用化疗药物作用机制不同,不存在交叉耐药性。并且SN-38的IC50在纳摩尔范围内(约1.0-6.0 nM),与目前ADC的其他毒素相比,具有中等效力。
戈沙妥珠单抗(SG,Sacituzumab Govitecan)最早由美国Immunomedics开发。云顶新耀在2019年,以6500万美元首付款,总价值8.3亿美元的费用,获得了本品在大中华区、韩国和部分东南亚国家开发、注册和商业化的独家权利。
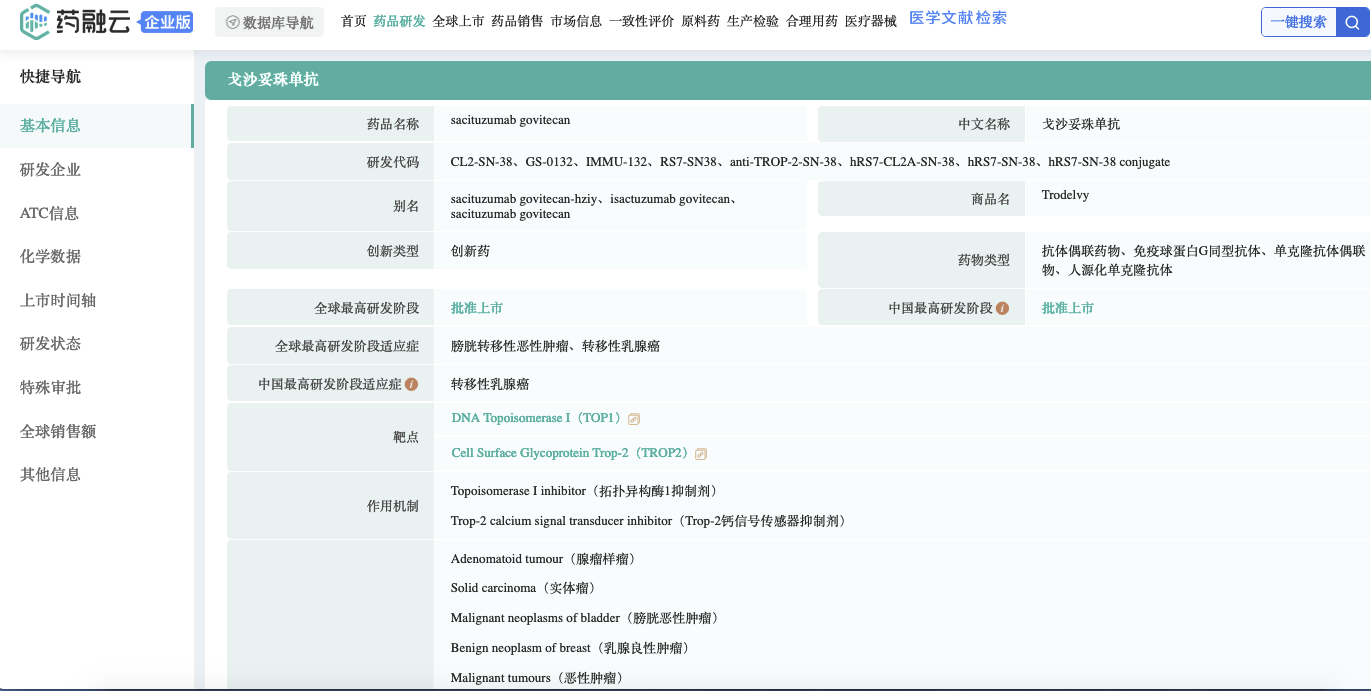
截图来源:药融云全球药物研发数据库
2020年9月,吉利德以总计210亿美元的价格收购了Immunomedics。2022年8月16日,云顶新耀以获得总额4.55亿美元的对价交易,把权益归还给 Immunomedics/吉利德。
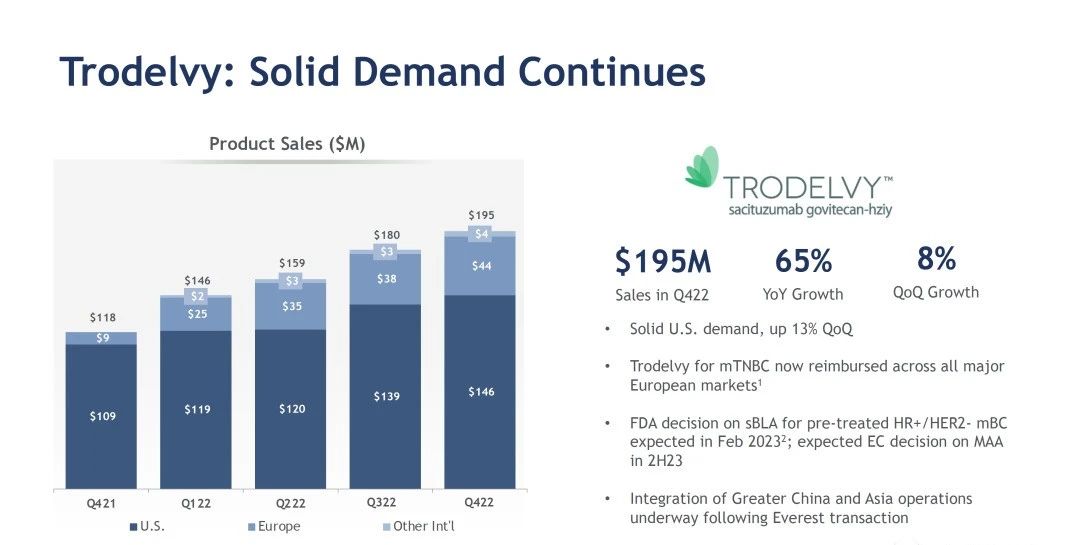
2023 年 2 月 3 日,美国FDA批准戈沙妥珠单抗(SG,Sacituzumab Govitecan)用于既往接受过内分泌治疗且 ≥2 线系统治疗(针对转移性疾病)的激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性(IHC 0、1+或 2+/ISH -)的不可切除的局部晚期或转移性乳腺癌患者。药融云数据库显示:本品2022财年全球业绩为6.8亿美元。2023年第一季度业绩为2.22亿美元,同比增长52%。
布局企业一览
药融云数据库显示,其他在布局Trop-2 ADC的企业有:SKB264(科伦博泰)、ESG-401(诗健生物)、BIO-106(百凯医药)、SHR-A1921(恒瑞医药)、百利天恒、百奥泰、JS108/DAC002(杭州多禧和君实生物)、映恩生物、复旦张江、信达生物进入临床试验阶段等等。其他有启德医药、思道医药、迈威生物(申报了IND)、豪森药业/翰森制药在研。
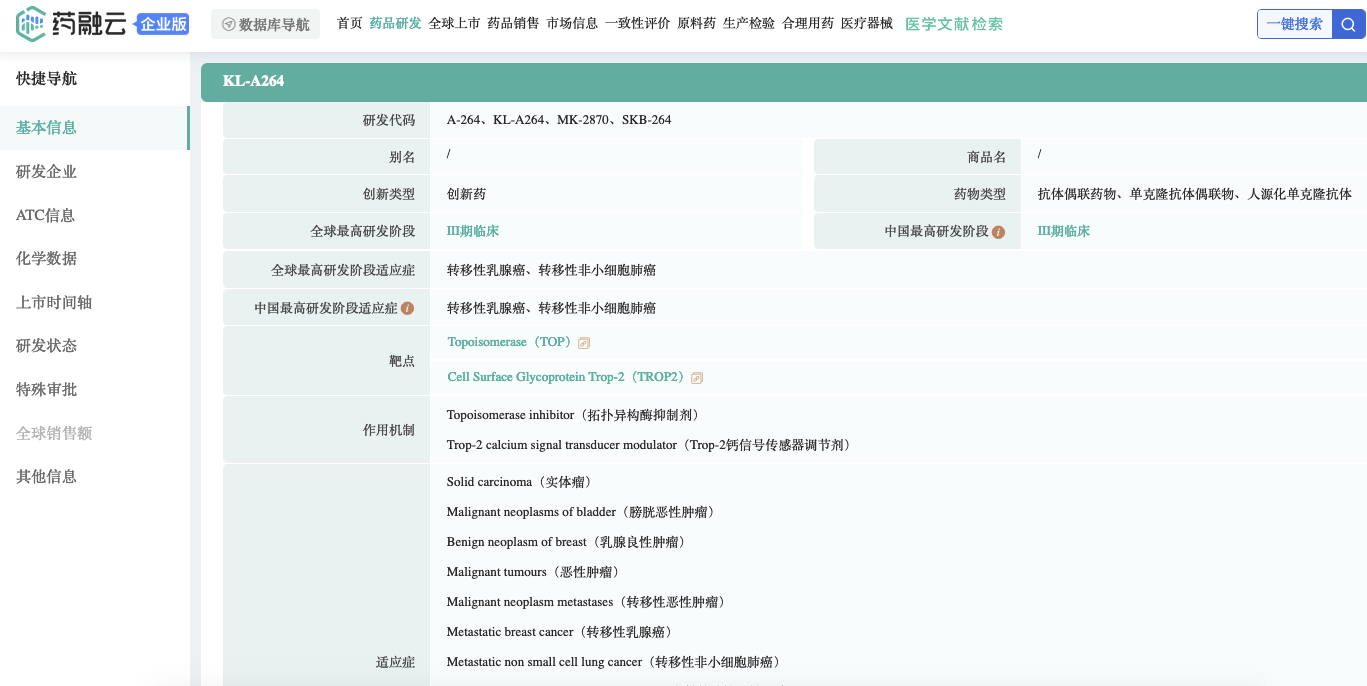
截图来源:药融云全球药物研发数据库
参考来源:
[1] NMPA/CDE
[2] 药融云数据库
[3]FDA/EMA/PMDA
相关公司公开披露;
www.gilead.com;
https://www.gilead.com/news-and-press/press-room/press-releases/2023/4/gilead-sciences-announces-first-quarter-2023-financial-results;
https://www.gilead.com/news-and-press/press-room/press-releases/2021/11/everest-medicines-and-gilead-sciences-jointly-announce-phase-2b-study-of-sacituzumab-govitecan-conducted-in-china-of-patients-with-metastatic-triple-n;等等。
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论