
10月31日,第一三共发布2023财年上半年(4-9月)业绩,总营收7263.4亿元日元(按汇率1 日元 =0.0066 美元算,约为48.11 亿美元),同比增长19.5%。
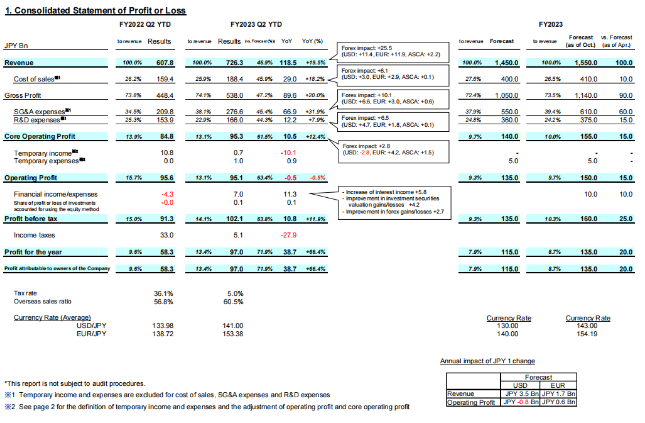
4-9月,ADC重磅产品Enhertu总收入1830亿日元(12.12亿美元),同比增长80%,包括1734亿日元(11.48亿美元)全球销售额以及96亿日元预付款和里程碑付款。第一三共和阿斯利康共同负责Enhertu在除日本以外的市场(第一三共拥有日本独家代理权)的开发和商业化。
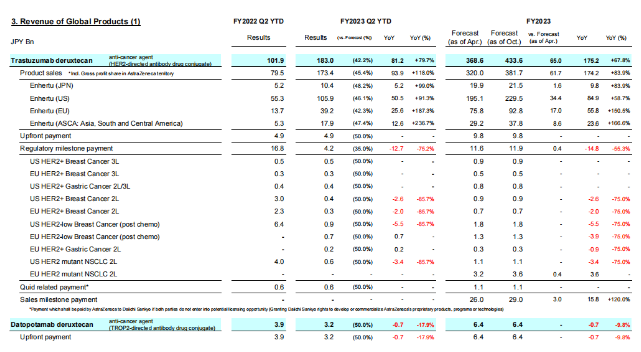
Enhertu适应症查询
截图来源:药融云全球药物研发数据库
4-9月,Enhertu美国市场销售额为1059亿日元(6.99亿美元),欧洲市场销售额392亿日元(2.59亿美元),随着多项已获批适应症人群渗透,预计全年美国市场将达到2295亿日元(15.15亿美元),欧洲市场全年将达到928亿日元(6.12亿美元)。
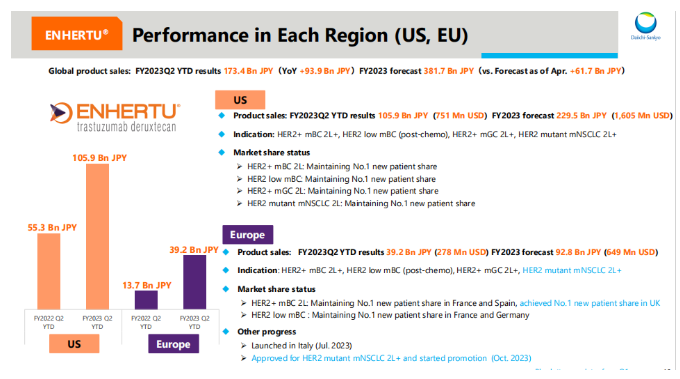
随着Enhertu在中国获批上市治疗HER2阳性晚期乳腺癌二线治疗和HER2低表达(IHC 1+或IHC 2+/ISH-)不可切除或转移性乳腺癌,其在亚洲市场也迎来了快速销售增长。
4-9月,Enhertu日本市场销售额为104亿日元(0.69亿美元),亚洲市场销售额179亿日元(1.18亿美元),随着多项已获批适应症人群渗透,预计全年日本市场将达到215亿日元(1.42亿美元),欧洲市场全年将达到378亿日元(2.49亿美元)。

ENHERTU®在美国又获得两项突破性疗法认证,用于以下适应症:
-治疗无法切除或转移的成年患者HER2+(IHC 3+)实体瘤成人患者的治疗,这些患者在既往治疗后病情进展,且没有令人满意的替代治疗方案(DESTINY-PanTumor02)。
-治疗既往接受过两种或两种以上治疗方案的HER2+(IHC 3+)转移性CRC患者(DESTINY-CRC01/02)
ENHERTU®在HER2表达实体瘤的DESTINY-PanTumor02研究中也获得了积极结果。
所有患者的ORR为37.1%,中位DOR为11.3个月。其中IHC 3+患者:ORR 61.3%,中位DOR 22.1个月,持久的反应带来了有临床意义的生存期(PFS)和生存期(OS),安全性与已知情况一致。
除此之外,Dato-DXd(datopotamab deruxtecan,DS-1062)是第一个在非小细胞肺癌中显示出比多西他赛显著改善PFS的ADC。Dato-DXd在非鳞癌2L+NSCLC中具有潜在的应用价值。在预先指定的亚组包括非鳞状组织学(Nsq;5.6个月vs3.7个月)中观察到更长的中位PFS。目前计划修改TROPION-Lung08研究方案,以覆盖鳞状人群。数据已与FDA共享,正在进行归档讨论。
HER3 ADC patritumab deruxtecan(HER3-DXd)在EGFR TKI和PBC治疗后疾病进展的EFGR突变NSCLC患者中显示出有临床意义和持久的疗效。
该公司还更新了DS-7300第1/2阶段研究的最新数据,结果显示:该药物在SCLC、ESCC、mCRPC和sqNSCLC等预处理严重的实体瘤患者中继续显示出持久的疗效。
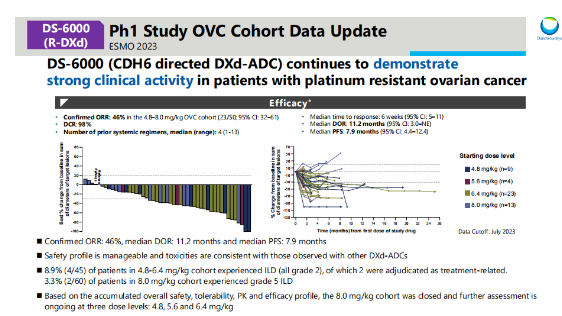
DS-6000(CDH6介导的DXd-ADC)在铂类耐药的卵巢癌患者中的I期研究Ovc Cohort数据更新结果显示,该药物仍表现出较强的临床活性。
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yry-public-oss.pharnexcloud.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)
















 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论