
近日,美国FDA宣布批准了SpringWorks (Nasdaq: SWTX)公司的Ogsiveo(nirogacestat,PF-03084014)片剂用于需要全身治疗的进展性硬纤维瘤成人患者,Ogsiveo是首个被批准用于治疗硬纤维瘤患者的药物。
Ogsiveo批准上市信息
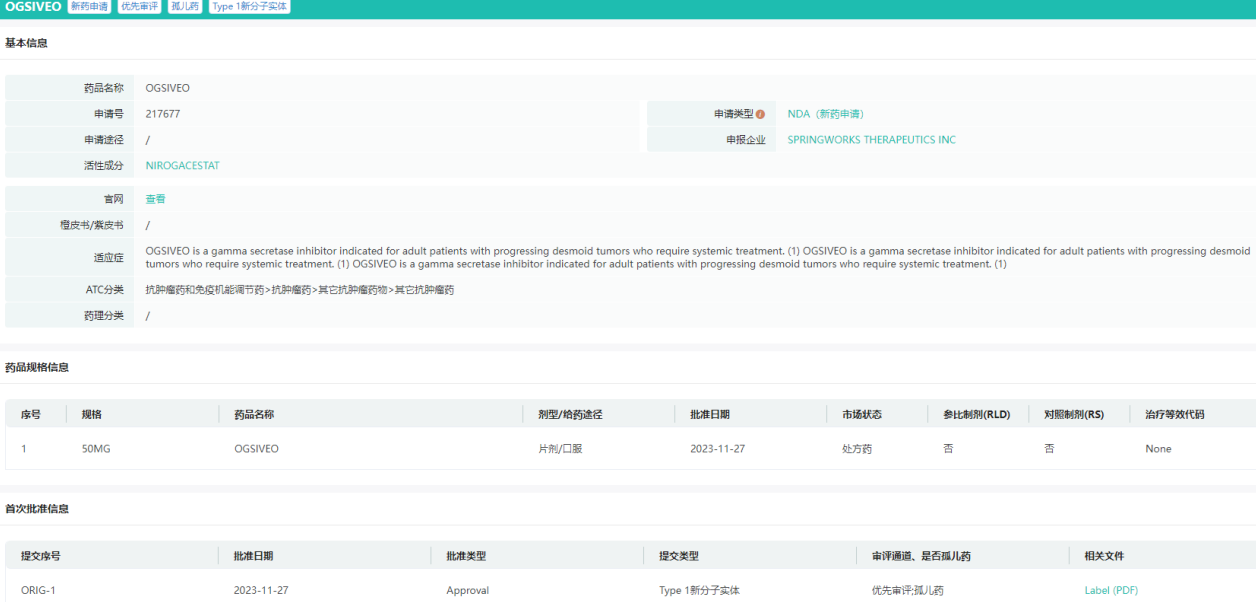
图片来源:药融云美国FDA批准药品数据库
硬纤维瘤也称韧带样瘤,是一种多发于青年的、罕见的软组织肿瘤。该疾病能侵入关节、肌肉、血管、神经和内脏等周围健康组织,可出现在身体的任何部位。硬纤维瘤及其相关症状的严重程度常随肿瘤的大小、位置和生长速度而变化。据估计,全世界每百万人中约有2到5人身患硬纤维瘤,美国每年有1000至1500例该疾病的新增病例。
此次Ogsiveo的获批是基于3期DeFi试验此前取得的积极结果。结果显示,DeFi试验达到了改善无进展生存期(PFS)的主要终点,Ogsiveo比安慰剂治疗有统计学上显著的改善,将疾病进展风险降低71%。基于RECIST v1.1的确认客观缓解率(完全缓解+部分缓解),Ogsiveo组为41%,安慰剂组为8%;Ogsiveo组的完全缓解率为7%,安慰剂组的完全缓解率为0%。此外,Ogsiveo在患者报告的结局(PROs)方面也显示出统计学意义和临床意义的改善。
Ogsiveo临床试验查询结果列表
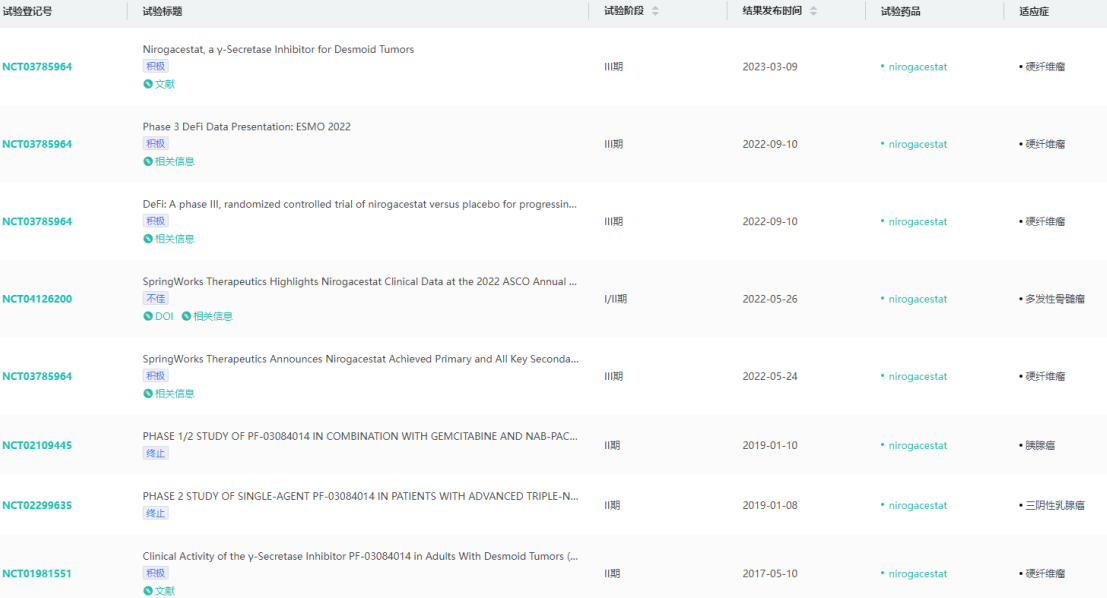
图片来源:药融云临床试验结果数据库
Ogsiveo在试验中还显示出可控的安全性,95%的治疗不良事件(TEAE)报告为1级或2级。试验中发生在至少15%患者的最常见副作用是腹泻、卵巢毒性、皮疹、恶心、疲乏、口腔炎、头痛、腹痛、咳嗽、脱发、上呼吸道感染和呼吸困难。
韧带样瘤可能对人们的生活产生重大影响,并且由于其侵袭性和高复发率而难以控制。OGSIVEO是一种高度创新的疗法,其疗效数据证明了有意义的抗肿瘤活性和韧带样瘤症状的显著改善,”纽约市纪念斯隆-凯特琳癌症中心(MSK)肉瘤医学肿瘤学家、3期DeFi试验研究员Mrinal M. Gounder医学博士说。“作为一名治疗医生,在DeFi试验中看到OGSIVEO在主要和所有关键次要终点方面取得了具有统计学意义和临床意义的改善,同时还具有可管理的安全性,这令人鼓舞。这一批准对患者来说是一个重要的治疗进步。”
Ogsiveo是一款口服特异性γ-分泌酶小分子抑制剂。γ-分泌酶能够切割多种跨膜蛋白复合体,其中包括Notch蛋白。而Notch蛋白被认为能够激活导致硬纤维瘤生长的信号通路。药融云数据库显示,Ogsiveo曾获得美国FDA授予快速通道资格、突破性疗法认定与优先审评资格,用以治疗进行性、不可切除复发或难治性硬纤维瘤或深部纤维瘤病成人患者。
Ogsiveo特殊审批
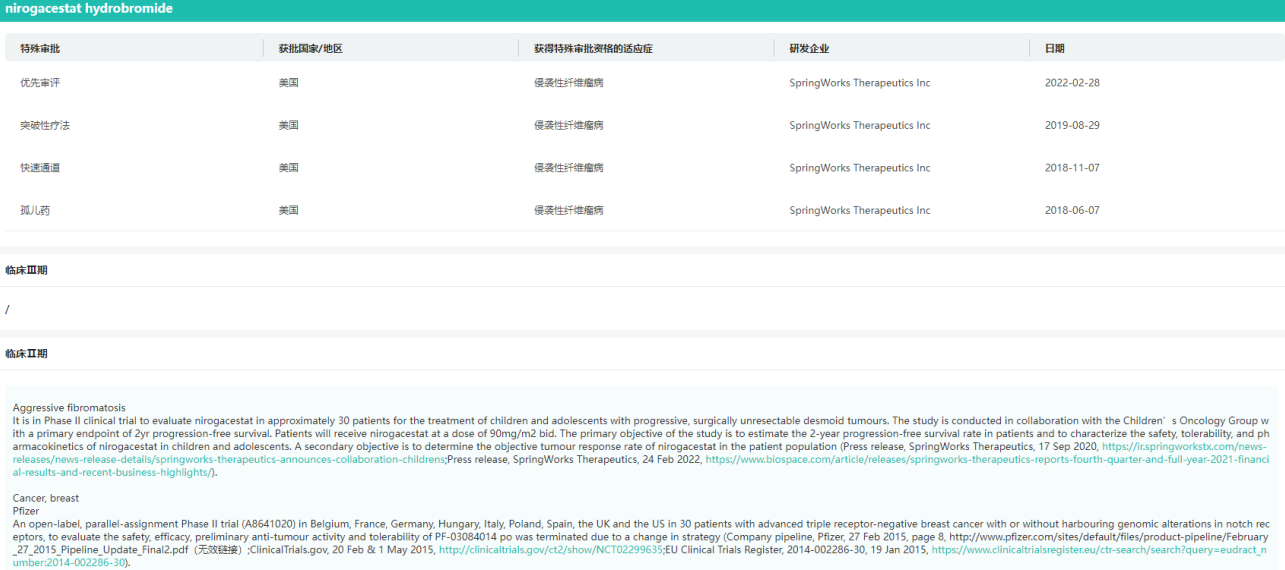
图片来源:药融云全球药物研发数据库
韧带样瘤是局部侵袭性和侵袭性软组织肿瘤,可导致相当高的发病率。此外,当重要结构受到影响时,韧带样瘤可能会危及生命。尽管硬纤维瘤不会转移,但它通常对现有的非适应症全身治疗难以控制,手术切除后的复发率高达77%。 韧带样瘤专家和治疗指南现在推荐系统性治疗作为一线干预,而不是手术治疗大多数需要治疗的肿瘤部位。
除了针对成人硬纤维瘤,SpringWorks公司还正在开发Ogsiveo作为卵巢颗粒细胞肿瘤患者和多发性骨髓瘤患者的潜在治疗方法,作为几种B细胞成熟抗原(BCMA)联合治疗方案的一部分。前期研究已证明Ogsiveo可增加BCMA在细胞表面的密度,并降低可溶性BCMA的水平,从而增强BCMA靶向治疗的活性。
关于SpringWorks Therapeutics
SpringWorks是一家处于商业阶段的生物制药公司,采用精准医学方法为患有严重罕见疾病和癌症的人开发和提供改变人生的药物。SpringWorks成立于2017年,成立之初就获得了辉瑞的四条研发管线授权,分别是治疗神经纤维瘤(NF)的PD-0325901、治疗遗传性干细胞增多症(HX)的PF-05416266、治疗硬纤维瘤的PF-03084014和治疗创伤后应激障碍(PTSD)的PF-0445784。
OGSIVEO(PF-03084014)在美国获得批准,用于治疗需要全身治疗的进行性硬纤维瘤成年患者,是SpringWorks的首个FDA批准的疗法。
SpringWorks融资信息查询
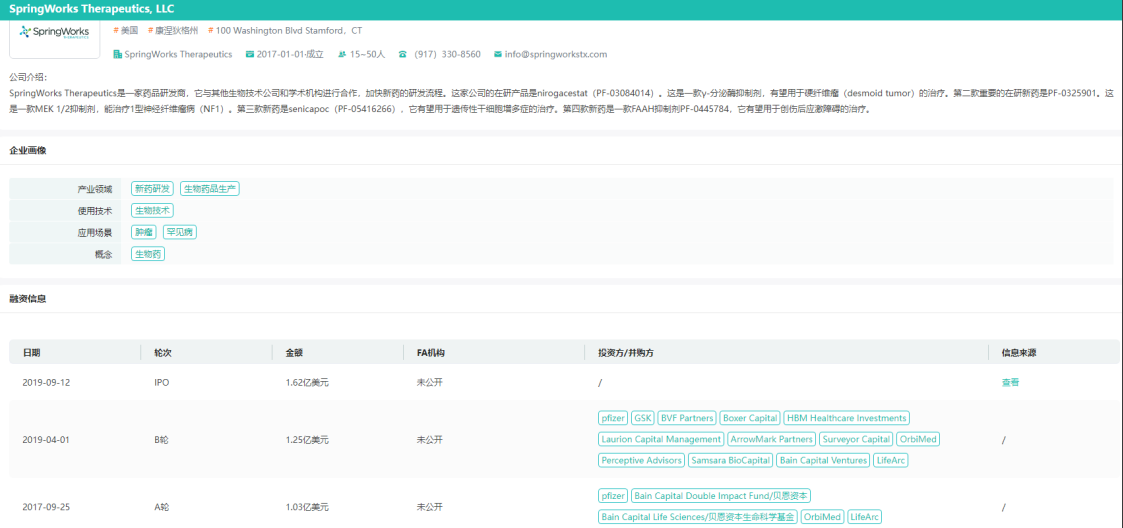
图片来源:药融云医药投融资数据库
值得一提的是,SpringWorks于2017年底从辉瑞公司分拆出来,就获得了1.03亿美元的A轮融资,投资方包括Bain Capital Life Sciences、Bain Capital Double Impact、OrbiMed、辉瑞,以及LifeArc等业内知名机构。
后又于2019年4月完成1.25亿美元的B轮融资,由Perceptive Advisors领投,原有投资者OrbiMed、贝恩资本、辉瑞风险投资、LifeArc和新增投资者Boxer Capital、HBM Healthcare Investments、BVF Partners、Surveyor Capital、Samsara BioCapital、ArrowMark Partners、葛兰素史克、Laurion Capital Management参投。
2019年9月,SpringWorks Therapeutics成功登陆纳斯达克,发行价18.00美元,开盘价24.50美元,实时股价22.63美元,涨幅高达45.22%。成立不过两年就完成了IPO,可见二级市场对于罕见病这块“小蛋糕”表现出了较为肯定的态度。
与百济神州、GSK达成合作协议
百济神州和SpringWorks于2018年9月达成了一项全球临床合作协议,评估百济神州的在研RAF二聚体抑制剂lifirafenib(BGB-283)与SpringWorks的在研MEK抑制剂PD-0325901联合用药在晚期实体瘤患者中的安全性、耐受性和初步疗效。药融云数据库显示,目前PD-0325901全球最高研发阶段处于II期临床。
PD-0325901全球研发状态
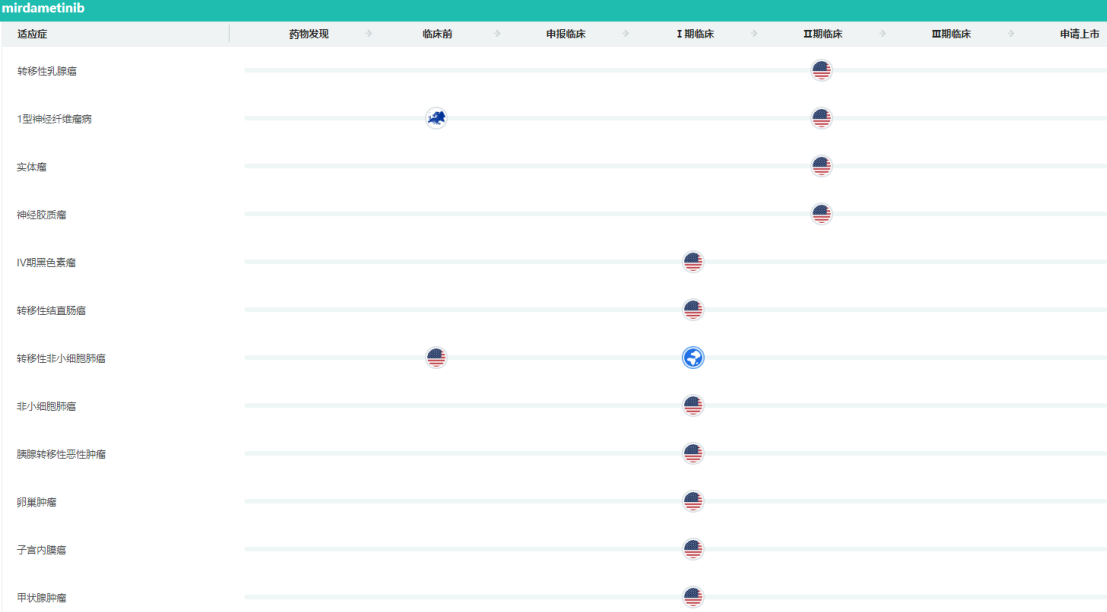
图片来源:药融云全球药物研发数据库
2019年6月,百济神州与SpringWorks宣布成立MapKure,旨在开发一款针对特定单聚体和二聚体B-RAF激活突变型的在研口服高选择性小分子抑制剂BGB-3245。根据合作条款,SpringWorks已对MapKure进行股权投资,百济神州则贡献了在亚洲以外国家和地区(包括日本)开发及商业化BGB-3245的独家版税和里程碑授权,以换取MapKure的多数所有权。当前BGB-3245处于临床II期研发阶段。
同年,SpringWorks还宣布与GSK达成一项临床研究合作协议。根据协议,SpringWorks在研产品nirogacestat将与GSK研发的抗B细胞成熟抗原(BCMA)抗体偶联药物belantamab mafodotin(GSK2857916)联合使用,评估这一组合治疗复发/难治性多发性骨髓瘤(MM)的效果。belantamab mafodotin于2020年8月已在美国获批上市,目前在国内处于III期临床阶段。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论