
2023年,国产创新药出海频传捷报,寻求广阔的海外市场依旧是国内各大创新药企的优先级议程。然而出海之路风高浪急,国产创新药项目对外授权(License-out)被动“收回”的数量也在增长。
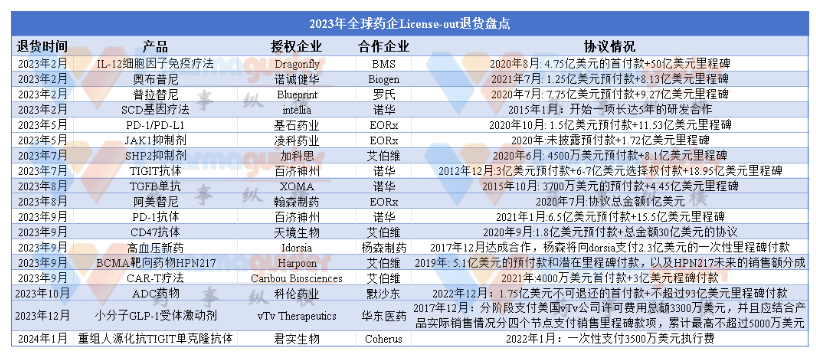
据不完全统计,2023年至今全球药企之间“退货”已达18例,其中国内药企出海遇阻案例已达10例,其中退货产品最多的公司是EORx、诺华、艾伯维;从退货产品来看,主要涉及抗体类,包括CD47抗体、PD-1抗体、TGFβ单抗、TIGIT抗体以及CGT等,大部分原因是合作方基于自身战略考量。
二月
2023年2月6日,Dragonfly Therapeutics宣布BMS已其新型白细胞介素-12 (IL-12)细胞因子研究性免疫疗法项目DF6002权益,Dragonfly现在拥有DF6002的全部开发权。BMS认为DF6002的临床表现未达预期,但Dragonfly并不认可这一说法,表明会加速DF6002在一系列适应症和组合方面的开发。而在此之前,BMS已在该项目上花费了6.5亿美元。

2023年2月15日,诺诚健华-B(09969)发布公告,渤健已通知公司终止双方就有望治疗多发性硬化(MS)和其他自身免疫性疾病的口服小分子BTK抑制剂奥布替尼的全球开发和商业化达成的合作和许可协议。诺诚健华将重获协议项下授予渤健的所有全球权利,包括相关知识产权、研发决策权、生产和商业化权益,以及源自奥布替尼的商业收益。双方将在90天内完成权益过渡。

2023年2月23日,Blueprint Medicines宣布罗氏因策略原因退还了RET抑制剂普拉提尼(商品名为Gavreto)的除大中华区外的全球权益。2020年6月,罗氏与Blueprint达成合作协议,罗氏已经花费约10亿美元。2018年6月,基石药业与Blueprint达成合作协议,获得普拉替尼的中国区权益。2020年9月,普拉替尼获得FDA批准上市。2021年3月,中国国家药监局附条件批准普拉替尼胶囊在华上市。2021年11月,欧盟委员会批准普拉替尼作为一种单药疗法。2022年7月,基石药业宣布普拉替尼胶囊在中国香港的新药上市申请获批。

2023年2月23日,Intellia Therapeutic在其第四季度财报中宣布,合作伙伴诺华已结束镰状细胞疗法OTQ923 / HIX763的开发。两家公司最早于2015年12月签订了长达5年的研发合作计划,希望凭借CRISPR/Cas9技术加速CAR-T疗法以及造血干细胞疗法的体外开发。2018年12月双方再次扩大协议,除了双方将继续致力于推进CRISPR/Cas9技术的应用外,还将诺华的LNP递送技术扩展到在研项目当中

五月
2023年5月9日,基石药业宣布将终止与EQRx关于舒格利单抗与nofazinlimab的许可协议,并将重获肿瘤免疫治疗药物PD-L1抗体舒格利单抗与PD-1抗体nofazinlimab在大中华区以外的开发与商业化权益。双方将致力于权益平顺过渡。本协议终止不会影响基石药业已从EQRx获得的首付款与里程碑付款。2020年10月,基石药业独家授权EQRx在大中华区以外地区开发及商业化舒格利单抗(CS1001,抗PD-L1单抗)和CS1003(抗PD-1单抗)。根据协议条款,基石药业将获得1.5亿美元的首付款,及最高可达11.5亿美元的里程碑付款以及额外的分级特许权使用费。
七月
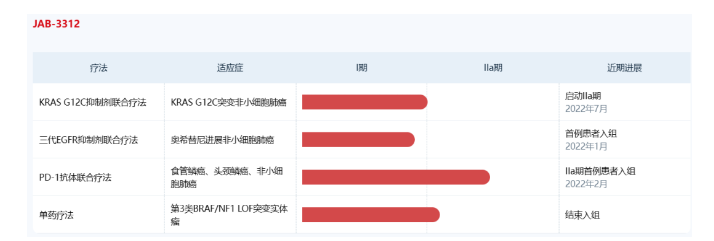
2023年7月4日,加科思发布公告,艾伯维基于资产组合与战略决策原因,就双方合作协议发出终止通知,退回SHP2抑制剂的全球权益,艾伯维将继续负担已经预先批准的开发计划下的所有费用。2020年6月,艾伯维以4500万美元预付款+8.1亿美元里程碑金额+一定比例销售分成,从加科思引进了两款SHP2抑制剂的全球权益。2022年,加科思又收到2000万美元里程碑付款。加科思SHP2抑制剂(JAB3312)正在进行全球IIa期临床试验,并积极推进KRAS G12C等联合疗法,预计将于今年下半年发布最新临床数据,将加速SHP2抑制剂的全球开发。
2023年7月11日,百济神州宣布公司已于7月10日与诺华签署就TIGIT抑制剂欧司珀利单抗业务的终止协议。这意味着,诺华放弃获得在若干国家和地区开发、生产和商业化欧司珀利单抗的独家许可。协议终止并不会影响此前已从诺华收到的3亿美元首付款。然而,根据此前的协议,合作若能顺利进行,百济神州还将陆续获得来自诺华的、包括选择权付款、里程碑付款以及分级许可使用费在内的款项,合计将超26亿美元。

八月
2023年8月4日,翰森制药发布公告,称收到海外合作伙伴EQRx关于终止有关阿美替尼的战略合作和许可协议的书面通知。阿美替尼是由翰森制药研发的第三代EFGR靶点药物,适应症为具有EGFR敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)。该药物于2020年3月在中国上市;2020年7月,翰森制药与EQRx达成协议,将阿美替尼在中国境外的研究、开发、生产、商业化权益交与EQRx。根据许可协议,翰森制药和豪森药业有权收取首付款和注册与发展里程碑付款,金额约1亿美元。许可协议终止将不会影响先前从EQRx获得的首付款与里程碑付款。

2023年8月25日,XOMA Corporation公司的SEC文件显示诺华致函表示计划停止与TGF β单克隆抗体NIS793相关的研发活动。Novartis将停止其余正在进行的TGFβ临床研究中的患者招募工作,并将在这些研究结束后收集所有数据。诺华于2015年10月首次获得NIS793的使用权,当时诺华以3700万美元的预付款从Xoma购买了该资产,NIS793里程碑的大约30%将作为XOMA对Novartis部分债务付款,剩余部分将以现金支付给XOMA。此外,XOMA有可能获得高达4.45亿美元的额外里程碑付款。若NIS793获得商业化监管批准,XOMA将获得一定百分比的销售分成。
NIS793基本药物信息

截图来源:药融云全球药物研发数据库

九月
2023年9月6日,Idorsia宣布,该公司已与强生旗下杨森制药达成协议,杨森将向Idorsia返还双重内皮素受体拮抗剂aprocitentan(用于治疗顽固性高血压)的专利使用权。根据协议,Idorsia将从杨森手中重新获得aprocitentan的开发和商业化权利。作为回报,Idorsia将根据Idorsia的收入,向杨森支付至多3.06亿瑞士法郎(25.14亿人民币,按最新汇率1.00 瑞士法郎 =8.21 人民币计算)的有条件报酬。

2023年9月13日,Harpoon宣布艾伯维公司将放弃对BCMA靶向多发性骨髓瘤药物HPN217的全球独家许可选择权。根据协议,该合作将于10月12日终止,之后HPN217将完全归Harpoon公司所有Harpoon计划继续完成正在进行的1期临床试验。2019年11月,Harpoon和艾伯维签订独家许可协议扩大相互之间的合作,促进Harpoon专有的TriTAC(三特异性T细胞活化构建体)平台的使用,以及Harpoon向艾伯维授予了其HPN217的全球使用权。此前艾伯维已支付了预付款5000万美元(HPN217预付3000万美元+扩大合作2000万美元)和首位患者入组治疗的里程碑付款5000万美元。

2023年9月19日,百济神州发布公告称全资子公司百济神州瑞士和诺华于18日签署了《共同终止和释放协议》,双方共同终止PD-1抗体tislelizumab(替雷利珠单抗,商品名:百泽安)的授权合作,百济神州由此重获替雷利珠单抗海外权益。2021年1月12日,百济神州宣布与全球制药巨头诺华就替雷利珠单抗在多个国家的开发、生产与商业化达成合作与授权协议,首付款为6.5亿美元,里程碑付款为15.5亿美元,总交易金额超过22亿美元,这是当时国内药物出售海外权益的最大交易金额。

2023年9月22日,天境生物宣布艾伯维终止CD47抗体的合作协议,该决定由艾伯维基于此前的项目终止和策略调整所作出。协议终止从11月20日起效,天境生物重获CD47抗体的全球权益,协议终止不影响天境生物已经获得的2亿美元预付款+里程碑金额。天境生物称,未来里程碑包括进一步分析来佐利单抗与阿扎胞苷联合治疗MDS二期临床后续数据,并结合其他在研CD47抗体的研究数据,以评估来佐利单抗后续的开发策略。

2023年9月26日,Caribou Biosciences透露,艾伯维 (AbbVie) 已终止与公司开发两款新靶点的通用CAR-T疗法的合作。艾伯维表示这是基于公司的战略重点决定的。AbbVie于2021年向这家初创公司预付了4000万美元,并承诺为两款新靶点的通用性CAR-T疗法提供高达3亿美元的研发和注册里程碑金额。艾伯维还将使用 Caribou 的下一代 Cas12a CRISPR杂合RNA-DNA (chRDNA) 基因组编辑和细胞治疗技术来研究和开发两种针对艾伯维指定靶点的新型CAR-T细胞疗法。AbbVie将负责细胞疗法的临床开发、商业化和制造,而Caribou将进行疗法的临床前研究、开发和制造。

十月
2023年10月23日,科伦药业公告宣布公司的控股子公司四川科伦博泰生物医药股份有限公司于2023年10月21日收到默沙东的正式书面通知,其决定终止科伦博泰向其授予的开发、制造和商业化一项临床前ADC资产的独家许可;不行使科伦博泰向其授予的独家选择权以获得另一项临床前ADC资产的独家许可。此前,科伦博泰已与默沙东签订三项许可及合作协议,以开发用于癌症治疗的多达九项 ADC 资产,包括已推进至临床阶段的三项 ADC 资产 (SKB264、SKB315 和 SKB410) 及多达六项临床前ADC资产。科伦博泰与默沙东就三项临床阶段ADC资产及四项临床前ADC资产的合作并未受到影响。

十二月
2023年12月22日,vTv Therapeutics宣布收到华东医药的通知,后者想要终止与vTv Therapeutics关于小分子GLP-1受体激动剂TTP273的授权合作。不过,合作终止的前提是双方协商并达成终止协议。2017年12月,华东医药“重金”引进TTP273,根据协议约定,华东医药应分阶段支付美国 vTv公司许可费用总额3300万美元,并且应结合产品实际销售情况(年净销售额1亿美元以上至7.5亿美元)分四个节点支付销售里程碑款项,累计最高不超过5000万美元。
2024年一月
2024年1月10日,君实生物发布公告称,收到Coherus关于终止重组人源化抗TIGIT单克隆抗体(项目代号:JS006)许可合作的通知函许可终止自公司收到通知函起六个月后生效。终止生效后,Coherus不再享有JS006的许可权利,公司重新获得开发、生产和商业化JS006的全部全球权利。此次终止不会影响公司前期已从Coherus 处收到的 3,500 万美元执行费及 Coherus 承担的研发费用等。2021年2月1日,公司与 Coherus 签署了《独占许可与商业化协议》。根据协议,公司授予 Coherus 特瑞普利单抗和两个可选项目(如执行)在美国和加拿大的独占许可,以及两个早期阶段检查点抑制剂抗体药物的优先谈判权。

总结
随着“退货”事件连续发生,国产创新药出海开始进入第二程。出海与否、出海机遇在哪儿,以及如何更好地出海,成为横亘在创新药企面前的考题。针对国内创新药企的产品遭外企合作方“退货”事件,要具体情况具体分析。有的是因为外企调整产品线战略,并非中方药企的产品本身有问题,中方企业仍然在积极推进产品研发;此外,还有价格因素影响合作。
投资者不应该仅凭借“退货”事件就轻易对药物宣判死刑,毕竟license-out的首付款已经到位,我国创新药企的竞争力也得到了显著增强。尽管背后原因各不相同。但是可以肯定的是,合作是必须的,因为只有合作,才能相互赋能、相互赋予价值,实现共赢。
参考资料:
各公司公告
药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论