
痛风是由高尿酸血症和关节周围的尿酸盐晶体沉积引起的病症。高尿酸血症是痛风形成的主要病因。痛风与高血压、肥胖、心血管疾病、糖尿病和慢性肾脏疾病等疾病有关,而这些合并疾病会让痛风治疗更为复杂,增加过早死亡风险。据统计,全球痛风患者人数超过5500万,高尿酸血症患者人数远远高于2亿人。

据《中国高尿酸血症与痛风诊疗指南(2019)》及国家统计局第六次人口普查数据显示,我国高尿酸血症的总体患病率为 13.3%,患病人数约为 1.77 亿,痛风总体发病率为 1.1%,患病人数约为 1466 万。
目前,痛风仍无法完全治愈,其治疗包括急性发作期治疗和长期治疗。其中急性发作期治疗以控制症状、消除疼痛和降低炎症为主要目的,常用药物为止痛药、皮质激素和秋水仙碱。长期治疗则是通过抑制尿酸生成或促进尿酸排泄的方式降低患者血尿酸水平。根据作用机制,痛风治疗药物可分为三大类:(1)抑制尿酸生成的黄嘌呤氧化酶抑制剂,如别嘌醇和非布司他;(2)促尿酸排泄尿酸盐转运蛋白1抑制剂,如苯溴马隆、雷西纳德和丙磺舒;(3)分解尿酸的尿酸氧化酶类似物。如聚乙二醇重组尿酸酶。
目前已上市的痛风治疗药物存在不同程度的副作用。药融云数据库监测显示,在中国市场仅仅URAT1靶点新药在研就有:江苏新元素医药的ABP-671、信诺维的XNW3009、益方生物 (Inventis Bio) 的 D-0120、珊顿医药、一品红/Arthrosi、成都海创药业的 口服HP501缓释片、 上海璎黎药业的YL-90148、先声药业从韩国JW Pharmaceutical引进的URC-102、台湾TWi Biotechnology的小分子药物AC-201 、天津药物研究院 、恒瑞医药SHR4640、基石药业 、海正药业 、 江苏艾立康药业、通化东宝THDBH130、复星复创、康缘药业等等 。期待各类研发的新药解决相关问题。
2020年2月25日,卫材株式会社和富士药品株式会社宣布,已就由富士药品研发用于治疗高尿酸血症和痛风的Dotinurad(URAT1抑制剂)达成许可协议,卫材将负责其产品在中国市场独家开发和销售。卫材将负责Dotinurad在中国的新药申请,并向富士药品支付首付款、开发里程碑和销售里程碑款项。
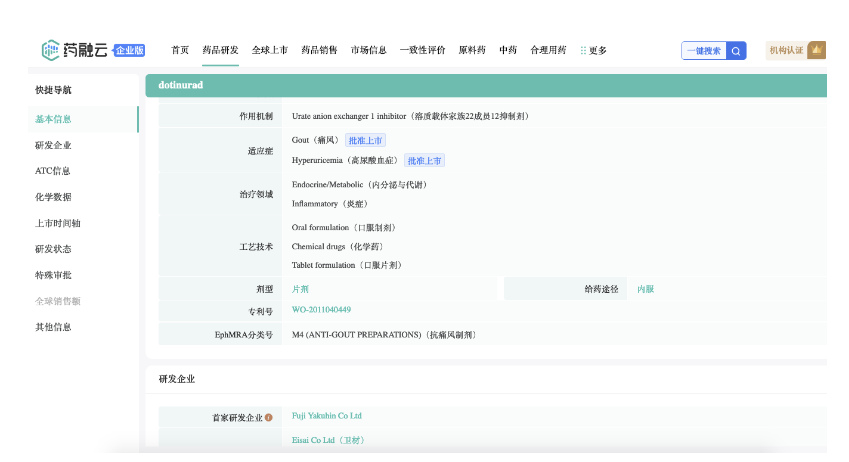
截图来源:药融云全球药物研发数据库
2024年1月22日,中国国家药品监督管理局(NMPA)药品审评中心(CDE)官网公示,卫材中国以注册分类5.1类申报的多替诺雷片上市申请已获得受理。多替诺雷片(Dotinurad,中国未来拟定的商品名:优乐思)是一款促尿酸排泄药,此前已经于2020年在日本首次获批上市,用于治疗高尿酸血症和痛风(富士药品、持田制药(Mochida)联合开发)。
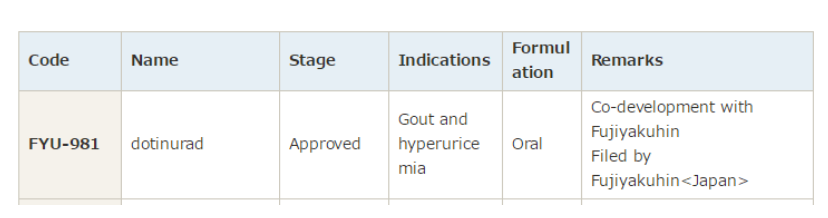
多替诺雷是一种新型痛风治疗药物,通过选择性抑制与肾脏中尿酸重吸收有关的尿酸盐转运蛋白(URAT1),抑制尿酸重吸收并降低血尿酸水平。作为一种URAT1选择性抑制剂,多替诺雷有效抑制肾近端小管URAT1而不影响尿酸排泄因子ABCG2和OAT1/3的功能,相比非选择性URAT1抑制剂降血尿酸的效率更高。
卫材在中国开展了一项旨在评估多替诺雷和非布司他治疗痛风疗效的3期临床研究(NCT05007392)。
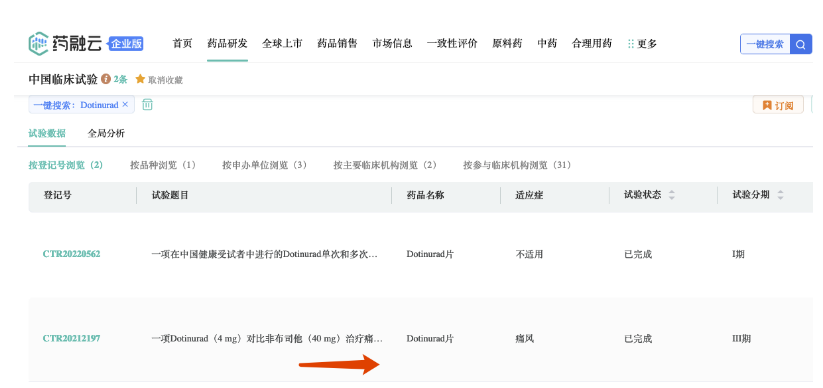
该研究纳入451例痛风患者,随机分为多替诺雷 4mg组和非布司他 40mg组,主要研究终点是治疗24周血尿酸水平≤ 6.0 mg/dL的患者百分比。此前在日本开展的一项3期临床研究结果显示,多替诺雷 4mg治疗伴或不伴痛风的高尿酸血症患者,58周血尿酸水平≤ 6.0 mg/dL的患者达标率100%。
参考:
NMPA/CDE;
FDA/EMA/PMDA;
相关公司公开披露;
http://www.eisai.co.jp/index.html;
http://www.mochida.co.jp/english/business/;等等
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论