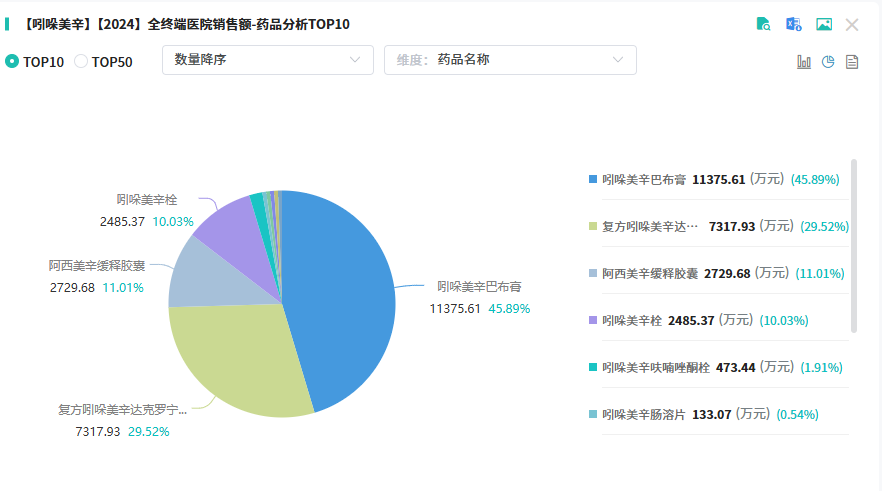
原研专利到期后,国内众多仿制药企纷纷涌入这一赛道。仅片剂剂型,截至目前就已有约96个批文,超60家企业通过或视同通过一致性评价。尽管集采使得片剂价格降至每片几分钱,但庞大的患者基数支撑着该品类年销售额稳定在40 - 60亿元,“重磅大药”的地位依旧稳固。
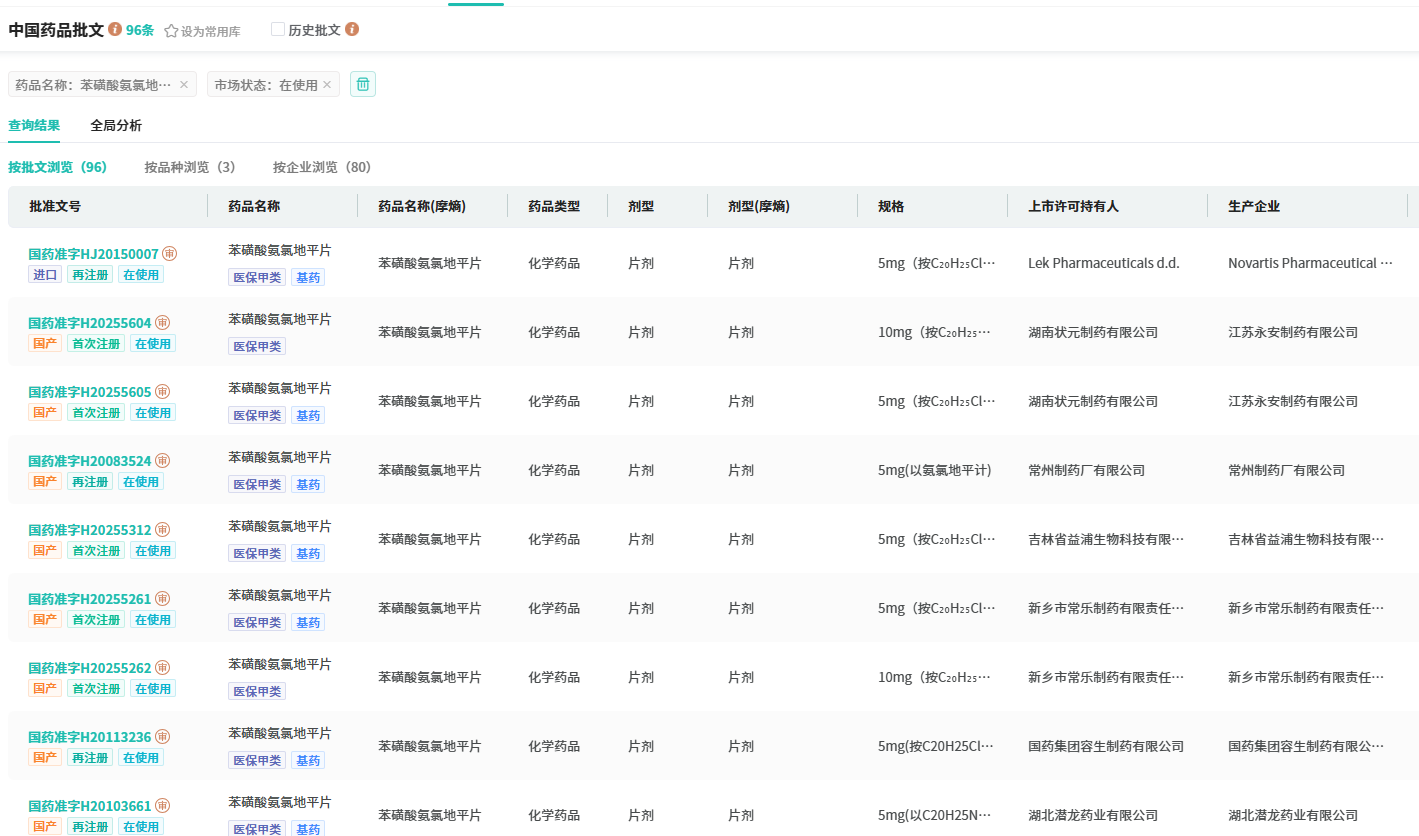
查数据,找摩熵!→图源:摩熵医药中国药品批文数据库
在这场激烈的竞争中,东阳光药也曾积极布局。2022年,它成功拿下片剂一致性评价;2023年,启动颗粒剂生物等效性试验;2024年11月,更是率先提交颗粒剂上市申请。然而,此次颗粒剂上市申请失利,给其布局之路蒙上了一层阴影。在东阳光药颗粒剂折戟后,颗粒剂型赛道仅剩浙江百代医药(联合浙江赛默制药)2025年7月申报的4个产品在审,竞争格局看似趋于明朗,但后续变数仍存。

查数据,找摩熵!→图源:摩熵医药中国药品审评数据库
不过,这种剂型改良的滞后也为国内其他企业创造了机会窗口。在其他剂型方面,竞争正逐渐升温,2024年1月一品红的干混悬剂获批,2025年6月广东万泰的口崩片获批,成为国内首个上市的苯磺酸氨氯地平口崩片。

查数据,找摩熵!→图源:摩熵医药中国药品批文数据库
在仿制药布局方面,目前国内仅有华益药业、浙江京新药业、广东万泰科创药业及深圳信立泰药业4家药企布局口崩片,市场竞争格局尚未完全形成。
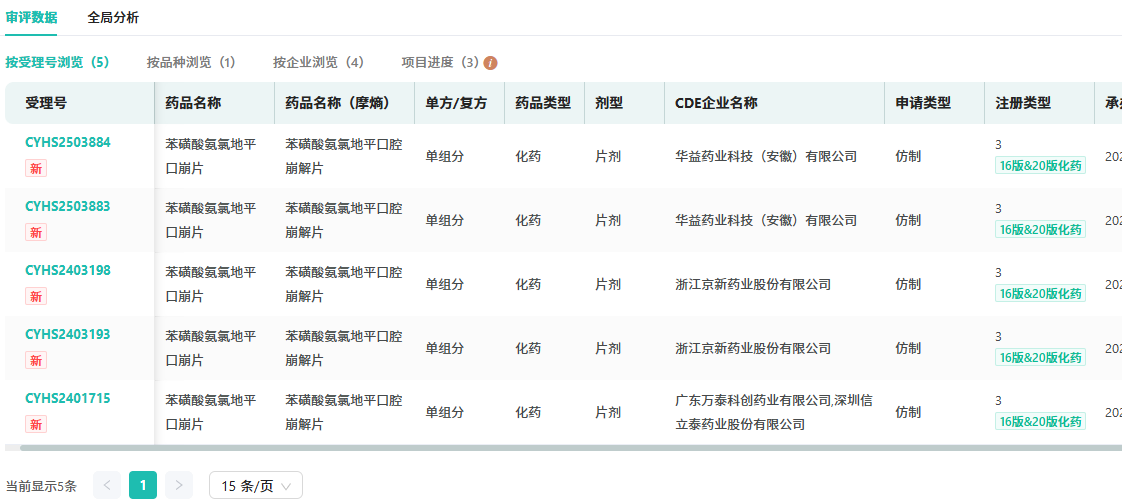
查数据,找摩熵!→图源:摩熵医药中国药品审评数据库
该品种并非首次申报失利,2015年河北元森制药就因临床数据造假被否。在竞争激烈的赛道上,国内扎堆开发在苯磺酸氨氯地平的颗粒剂、口崩片、干混悬剂等改良剂型,究竟是挖掘到临床刚需“蓝海”,还是陷入同质化竞争,值得行业深思。
小结
此次国家药监局否决众多药品上市申请,尤其是13款首仿失败,反映出药品审批的严格化趋势。九典制药在吲哚美辛凝胶贴膏首仿上的失利,以及东阳光药在苯磺酸氨氯地平颗粒剂申报上的受挫,都给药企敲响了警钟。在竞争激烈的医药市场,药企不仅要注重研发速度,更要保证研发质量,避免盲目跟风开发改良剂型,应聚焦临床刚需,以提升自身竞争力,才能在市场中立足。
附件:
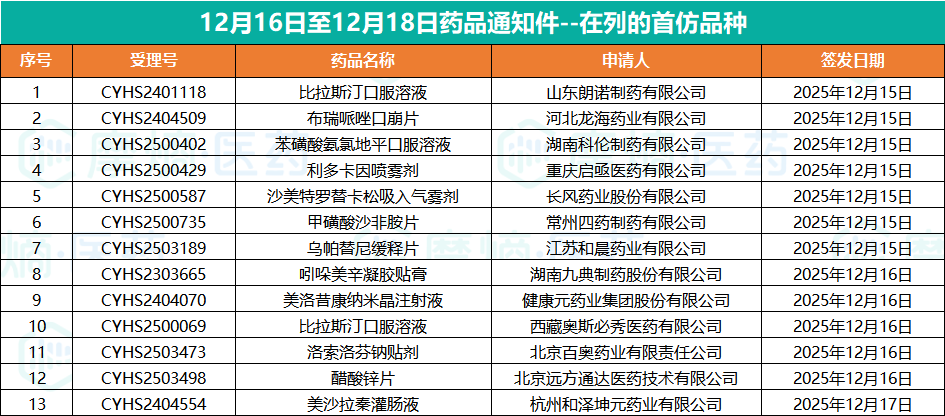
参考来源:
[1] CDE/NMPA官网
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 东阳光药业1类新药HEC169584获批临床,针对NASH展现高效研发实力
2. 对东阳光芬戈莫德胶囊在美上市遇阻击的后续展望
3. 科伦药业再冲首仿!4类仿制化药布瑞哌唑片上市申请获CDE受理
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论