政策法规
-

最新CDE临床相关指导原则!关于西妥昔单抗与长效重组人粒细胞
今日,CDE官网发布了关于《西妥昔单抗注射液生物类似药临床试验设计指导原则(试行)》、《长效重组人粒细胞集落刺激因子预防化疗后中性粒细胞减少性发热临床试验设计指导原则(试行)》两条指导原则,文末附有指导原则全文。 -

中药崛起!又一中医药重磅发展规范出台!中医药国际化战略!
近期中医药支持政策不断,2021年底,国家医疗保障局联合国家中医药管理局发布了关于医保支持中医药传承创新发展的指导意见。 -
-

NMPA发布:细胞治疗产品GMP最新规定!
为贯彻实施《中华人民共和国药品管理法》,国家药监局组织起草了《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》(附件1),现面向社会公开征求意见。 -

中药产业大时代!国内「中药政策」全面解读!
中药产业是我国医药卫生事业的重要组成部分,长期以来,国家持续鼓励中医西医相互学习,相互补充,协调发展,发挥各自优势,促进中西医结合。近2年,中药在防控、诊治新冠病毒形式下发挥了极大的作用。同时,中药也成为了医药行业内备受关注的热点。因此,本文拟从政策角度出发探索长期以来国内中药产业发展情况。 -

CDE发布《罕见疾病药物临床研发技术指导原则》
罕见疾病的单病种发病率极低,药物研发的难度远远超过常见多发疾病。为促进罕见疾病药物研发,在国家药品监督管理局的部署下,药审中心组织制定了《罕见疾病药物临床研发技术指导原则》(见附件)。 -

CDE发布仿制药晶型研究指导原则!可选参比不同晶型
对于仿制药,通常情况下应选择与参比制剂一致的晶型。若有足够的稳定性研究数据支持且其他晶型制备的仿制药与参比制剂生物等效,也可选择与参比制剂不同的晶型。无论选择何种晶型,均应对所选择晶型进行充分的理化性质和稳定性研究。 -
CDE最新发布10条指导原则,今年拼了!涉新药、仿制药;涵制剂、临床等
进入2022年,CDE指导原则不断,开工短短2天发布8条指导原则,可能还会不断增加,涉新药、仿制药;涵制剂、临床等. -

药监局CFDI发布药品生产现场核查新规!
按照《药品注册管理办法》(国家市场监督管理总局令 第27号)及《药品注册核查工作程序(试行)》(国家药品监督管理局食品药品审核查验中心通告2021年第30号)规定,为进一步规范药品注册核查,保证核查的公平与效率,现将药品注册申请人(以下简称申请人)确认接受生产现场核查有关事宜通告如下。 -
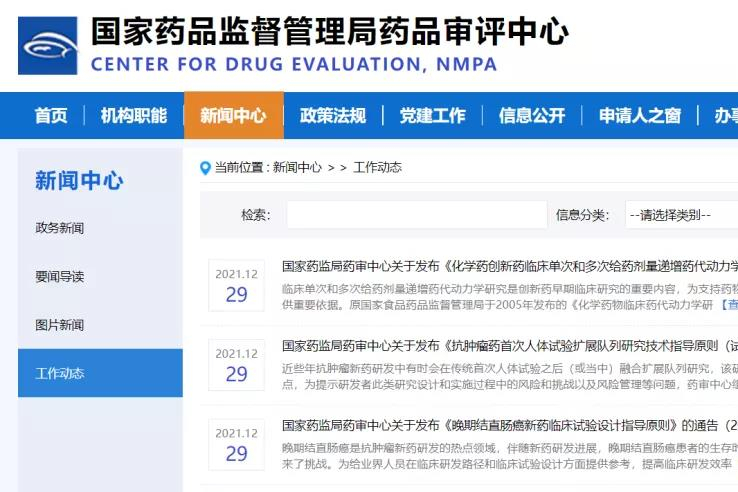
CDE:创新药临床指导原则3连发!!
刚刚CDE发布了3个创新药临床相关指导原则:;《化学药创新药临床单次和多次给药剂量递增药代动力学研究技术指导原则》;《抗肿瘤药首次人体试验扩展队列研究技术指导原则(试行)》;《晚期结直肠癌新药临床试验设计指导原则》。









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息