齐鲁制药复方获批而单方被否,猜测CMC原因的可能性较低,临床原因概率较大。毕竟抗PD-1单抗获批上市的品种众多,审评机构对于后来者临床优势有更高的要求。
据摩熵医药数据库-中国药品审评库显示,国内已有16个品种被批准生产/进口,竞争非常激烈。
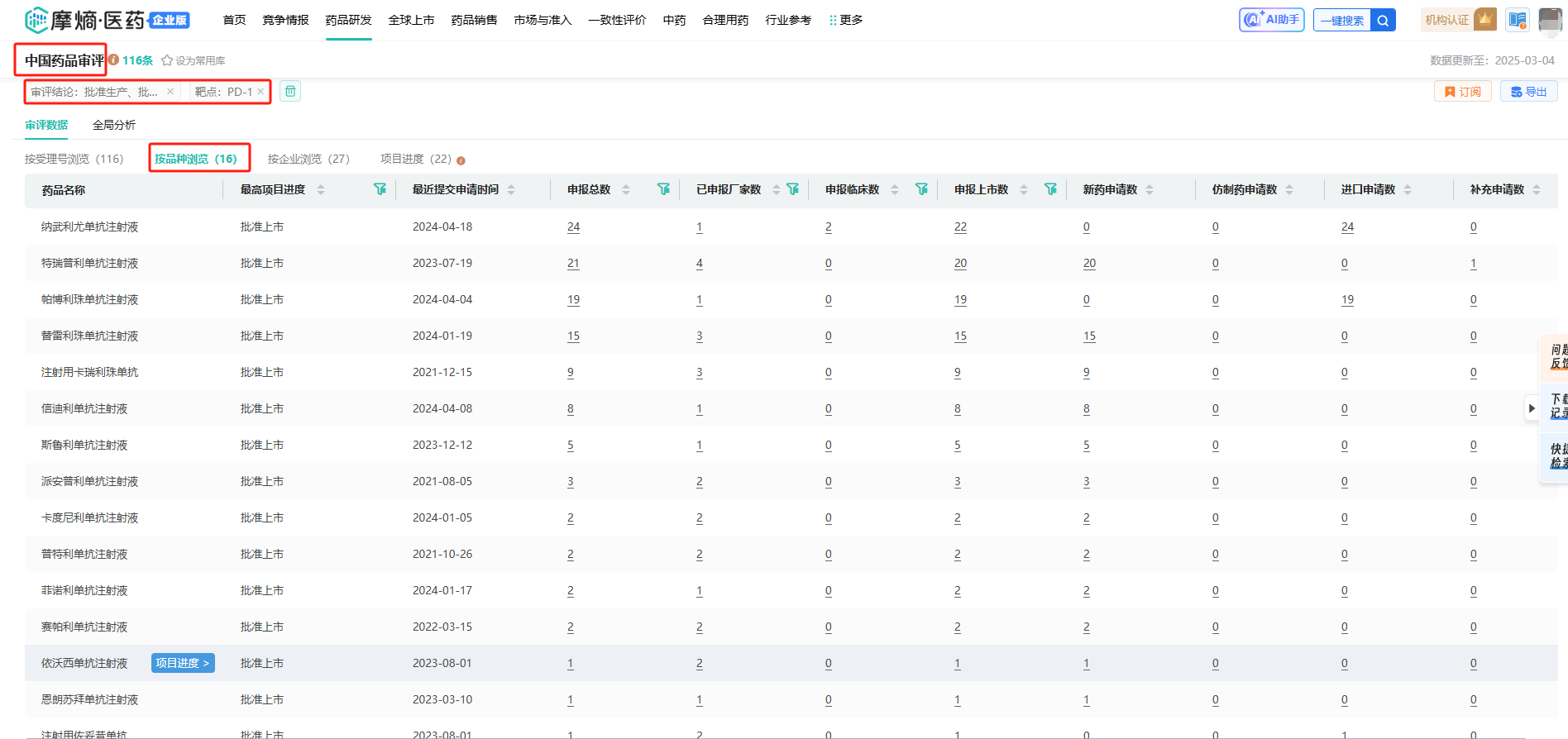
截图来源:摩熵医药中国药品审评数据库
第二个产品为乐普生物的注射用维贝柯妥塔单抗,研发代号MRG003,为靶向EGFR的ADC,在研适应症为二线或以上NPC(鼻咽癌)或HNSCC(头颈部鳞状细胞癌)。其中鼻咽癌适应症上市申请于2024年9月获得受理,并获优先审评资格。
在晚期鼻咽癌的治疗上,其 II 期研究结果显示,61 例既往经铂类和 / 或 PD-(L) 1 抑制剂治疗失败的患者接受治疗后,2.0mg/kg 队列的客观缓解率(ORR)达到 39.3%,2.3mg/kg 队列的 ORR 更是高达 55.2%,疾病控制率(DCR)分别为 71.4% 和 86.2% 。
该产品被寄予了很高的期望,各种荣誉加持:FDA突破性疗法,国内有优先审评和突破性治疗。
3月3日,乐普生物最新公告称,出现通知件原因为CDE要求补充相关资料,所以企业撤回申请,并于今天重新递交上市申请。公司股价盘中一度跌了17.85%,收盘跌幅缩窄至4.82%。

截图来源:企业公告
据摩熵医药-全球药物研发数据库显示,针对EGFR靶点的ADC药物中,MRG003在全球位于领先的位置。
全球仅有MRG003处于申请上市阶段,临床III期阶段除了该药的头颈部鳞状细胞癌适应症外,还有百利天恒的BL-B01D1(EGFR×HER3 双靶点ADC)单药用于既往含铂化疗及抗PD-1/PD-L1单抗治疗失败的复发性小细胞肺癌;石药集团SYS6010(EGFR ADC)单药用于治疗经EGFR-TKI和含铂化疗治疗失败的EGFR突变阳性晚期非小细胞肺癌,已获得国家药品监督管理局的突破性治疗认定。
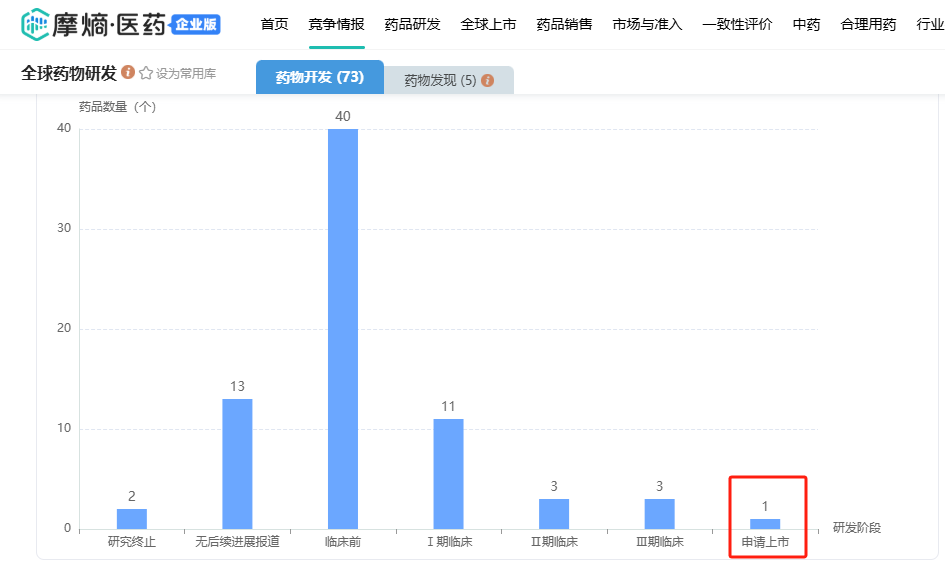
截图来源:摩熵医药全球药物研发数据库
小结
新药研发面临多重风险,涵盖从临床前研究到上市后的全生命周期。法规政策变化(如审批标准提升)和市场需求波动(如竞品上市或治疗手段革新)显著影响研发回报。
为应对这些风险,需实时跟进竞品进度,识别潜在的市场窗口期。同时,动态调整申报策略,根据竞品数据优化试验设计(如调整入组标准或终点指标)。通过整合风险管理工具(如风险评估矩阵)与实时数据分析,企业可提升决策效率,降低研发不确定性。
参考来源:
[1] NMPA官网
[2] 摩熵医药(原药融云)数据库
[3] 公司官方公告
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论