
根据4月25日国家药监局最新药品批件,本文将为大家盘点几款新药的新适应症获批情况。

截图来源:国家药品监督管理局网站
一、依沃西单抗
依沃西单抗为康方生物全球首创的PD-1/VEGF双特异性抗体新药,2024年5月,该产品首次在中国获批上市,用于EGFR突变且经TKI治疗进展的局部晚期或转移性非鳞状非小细胞肺癌(nsq-NSCLC),成为全球首个“肿瘤免疫+抗血管生成”机制的双特异性抗体药物。

该药本次获批的适应症为:单药用于PD-L1阳性[肿瘤比例评分(TPS)≥1%]的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的局部晚期或转移性非小细胞肺癌(NSCLC)的一线治疗。
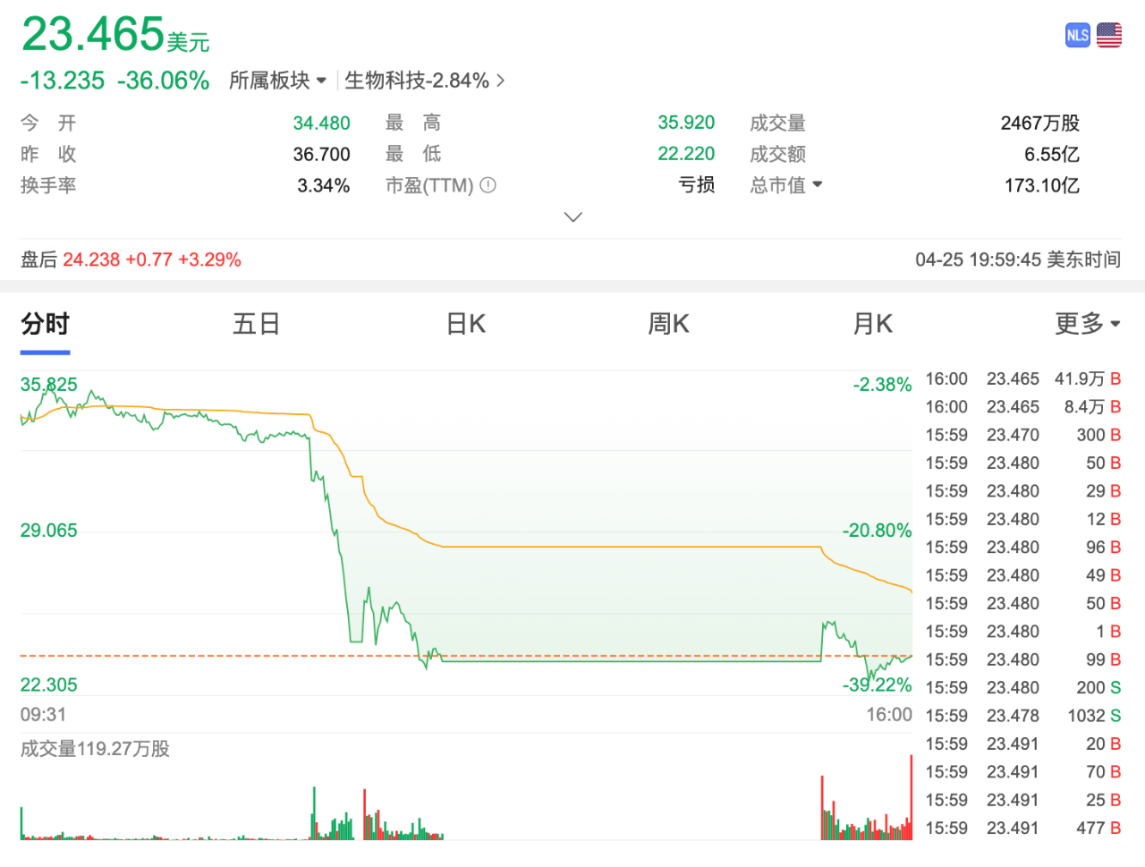
本次新适应症获批,是基于HARMONi-2(AK112-303)研究,该研究中,依沃西单抗与K药帕博利珠单抗头对头比较。结果显示,依沃西单抗组和帕博利珠单抗组的 mPFS 分别为 11.14 个月和 5.82 个月;依沃西单抗治疗组疾病进展/死亡风险降低达 49%。依沃西单抗相比帕博利珠单抗,显著提高了 PD-L1 阳性 NSCLC 患者一线治疗的客观缓解率(50.0% vs 38.5%)和疾病控制率(89.9% vs 70.5%)。
但由于披露的OS结果不及预期,基于39%预设死亡事件时的数据分析显示,与K药相比,依沃西单抗将死亡风险降低了22.3%(风险比HR=0.777)。这一数据未能跨越预先设定的统计学显著性门槛(α=0.0001)。导致即使HR数值扎实(0.777低于多数肿瘤学家认可的0.8临床意义阈值),仍未能满足投资者对“确定性”的期待。海外合作伙伴 Summit Therapeutics 4月25日收盘暴跌36%。
二、特瑞普利单抗
特瑞普利单抗(Toripalimab,商品名:拓益®,LOQTORZ)是由君实生物自主研发的一款国产广谱抗癌药,此前,特瑞普利单抗已在中国内地获批11项适应症,涵盖黑色素瘤、鼻咽癌、尿路上皮癌、食管鳞癌、非小细胞肺癌、肾癌、小细胞肺癌、三阴性乳腺癌、肝细胞癌等适应症。在国际范围内,特瑞普利单抗目前已在美国、欧盟、印度、英国、约旦、澳大利亚、新加坡等国家和地区获得批准上市,并在全球多个国家或地区接受上市审评。

此次获批的适应症为用于不可切除或转移性黑色素瘤一线治疗,它也成为了首个覆盖晚期黑色素瘤一线免疫治疗的国产PD-1单抗。作为国内首款获批上市的PD-1单抗药物,特瑞普利单抗此次获批具有里程碑意义,它填补了国内该领域的治疗空白,为晚期患者提供了更有效的一线免疫治疗新选择。
三、利厄替尼
利厄替尼(limertinib,ASK120067)是一款具有全新分子实体、活性显著的口服的第三代EGFR-TKI。2024年10月,奥赛康与信达生物就利厄替尼片在中国达成独家商业化合作,信达生物取得该产品在中国大陆地区的独家推广销售权。

2025年1月,利厄替尼首次获NMPA批准用于既往经EGFR-TKI治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性,局部晚期或转移性非小细胞肺癌(NSCLC)成人患者治疗。
本次为该产品获批的第二项适应症。该药本次获批的定适应症为:具有EGFR外显子19缺失(19DEL)或外显子21置换突变(L858R)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
四、奥布替尼
奥布替尼是诺诚健华研发的一款不可逆布鲁顿酪氨酸激酶(BTK)抑制剂,可用于治疗淋巴瘤及自身免疫性疾病,其创新的分子结构使其能够更精准地作用于 BTK 靶点,具有更好的靶点选择性和亲和力,能够更有效地抑制肿瘤细胞的生长和扩散。
2020年12月,奥布替尼在中国获批用于治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)、以及复发/难治性套细胞淋巴瘤(MCL)两项适应症。2023年4月,奥布替尼获批用于既往至少接受过一次治疗的边缘区淋巴瘤(MZL)患者。该药本次获批的适应症为一线治疗慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)。
作为诺诚健华核心管线之一,奥布替尼还有多项上市申请已在多个国家处于上市审评阶段,包括在澳大利亚用于既往至少接受过一次治疗的套细胞淋巴瘤(MCL)的NDA上市申请;在新加坡奥布替尼用于既往至少接受过一次治疗的MZL患者的NDA上市申请。在自身免疫性疾病领域,该产品也正在针对多项适应症推进临床开发,其中治疗原发进展型多发性硬化(PPMS)、原发免疫性血小板减少症(ITP)已进入3期临床阶段。
小结
2025年以来,我国创新药领域在海外合作、新药研发及适应症拓展方面取得显著进展。海外授权合作持续火热,NewCo模式成为新趋势,多个新药及适应症获批,这些进展标志着中国创新药在全球化布局、技术突破及临床价值转化上的全面提升,凸显研发从跟随式向源头创新过渡。
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论