2021年7月19日,欧盟委员会(EC)通过孤儿药、优先药物等方式批准Bylvay (odevixibat,A4250)用于治疗进行性家族性肝内胆汁淤积症(progressive familial intrahepatic cholestasis,PFIC)。据悉,这是全球第一个被批准用于治疗PFIC所有亚型的药物,它也代表了PFIC治疗方式的彻底转变。
7月20日,美国FDA通过快速通道、孤儿药等方式批准了该药物治疗PFIC的上市申请。

数据来源:FDA官网
一、只能手术治疗的罕见病?首款药物终于诞生!
进行性家族性肝内胆汁淤积症(PFIC)是一种罕见的、极具破坏性和毁灭性的疾病。大多数PFIC患者在10岁前会发生肝硬化和肝功能衰竭,几乎所有PFIC患者都需要在30岁前接受治疗。PFIC还在2018年5月在我国被纳入《第一批罕见病目录》。
此前,治疗PFIC只能采取手术(胆管分流术或肝移植)方式,若不进行手术,大多数PFIC患者无法活到30岁以上。此外,目前的肝移植标准护理还面临着终生的免疫抑制、为幼儿寻找器官等挑战。
此次获批的Bylvay是第一个获批治疗PFIC的药物,并且Bylvay适用于全部亚型的PFIC儿童患者,PFIC治疗方式出现彻底转变。
Bylvay由Albireo Pharma研发,活性成分是odevixibat,是一种首创强效选择性、非系统性、回肠胆汁酸转运体(IBAT)抑制剂,具有最小的全身暴露,在肠道内局部发挥作用。目前odevixibat作为治疗PFIC的first in class在欧盟和美国批准上市,并即将在澳大利亚、加拿大、以色列等地区上市。
Albireo Pharma 公布适应症为PFIC的关键III期临床试验(PEDFIC 1)数据显示,该药达到了美国和欧盟监管要求的主要终点:
◆ PEDFIC 1数据与先前一致,odevixibat达到FDA设置主要终点:odevixibat治疗组瘙痒评估阳性率为53.5%、安慰剂组为28.7%(p=0.004),显著改善了皮肤瘙痒;
◆ 同时还达到EMA设置主要终点:odevixibat治疗组有33.3%的患者血清胆汁酸(sBA)降低70%或达到70μmol/L水平,p=0.003,显著降低了胆汁酸反应。
◆ 不良反应方面,最常见的不良事件——腹泻/频繁排便odevixibat组发生率为10%,安慰剂组为5%,耐受性良好。
二、多种适应症的试验同时开展中PFIC试验进展最快
据药融云药品研发数据库,与此同时,Odevixibat针对PFIC、Alagille综合征、胆道闭锁、原发性胆源性胆管炎、瘙痒症等诸多适应症的临床试验正在多地区开展。见下图:
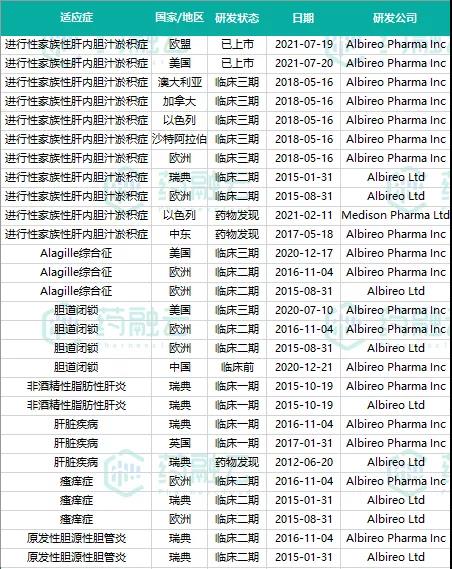
数据来源:药融云药品研发数据库
Alagille 综合征
Alagille综合征是具有表型特征的慢性胆汁淤积的最常见原因,是一种累及多系统的显性遗传性疾病。Alagille综合征涉及的脏器包括肝脏、心脏、骨骼、眼睛和颜面等,国外报道该病的发病率约为1/70000。国内近年来开始关注该病,虽仍无发病率的资料,但研究发现其同样是我国儿童慢性胆汁郁积的重要原因之一。
针对Alagille 综合征适应症,Albireo Pharma已于2020年12月11日在美国开启临床III期试验。
胆道闭锁
胆道闭锁是导致新生儿阻塞性黄疸并需手术治疗的最常见疾病。表现为肝外(部分包括肝内)胆道闭锁。胆管呈纤维细索状,或完全缺如。发病率在活产新生儿中为1∶15000,女性稍多于男性。
针对胆道闭锁适应症,Albireo Pharma 已于2020年7月10日在美国开启临床试验III期。
三、肝内胆汁淤积症治疗药物的研发现状
据药融云数据库,针对肝内胆汁淤积症的治疗,除Odevixibat外,目前全球还有多款药品在研发中。其中,maralixibat同属小分子治疗药,研发进展最快,已提交上市申请;其余药物均为生物药,均处于临床前或无后续进展报道。详见下表。
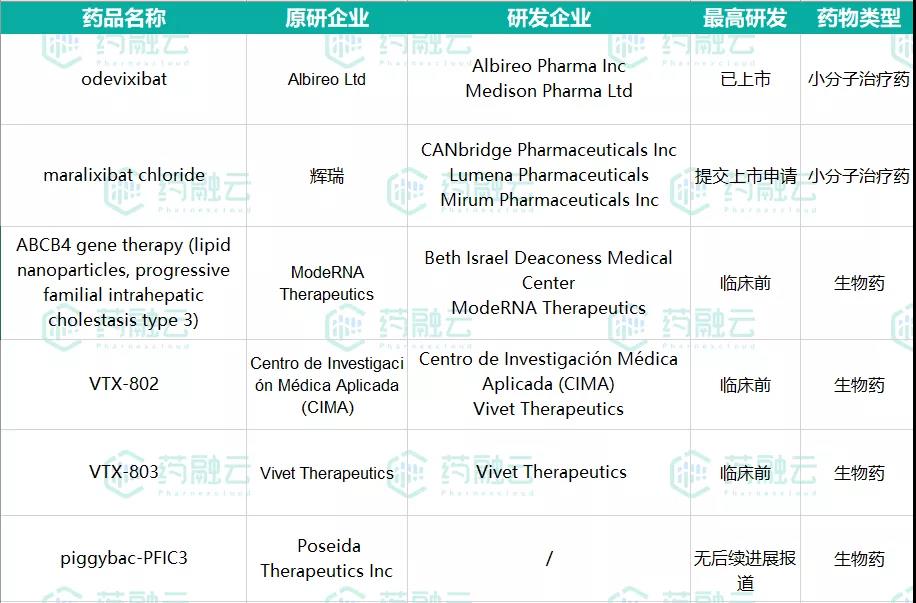
数据来源:药融云全球药物研发数据库
maralixibat紧随其后,即将上市
maralixibat是一种新型的口服选择性钠依赖性胆汁酸转运蛋白(ASBT)抑制剂,通过抑制ASBT,使得更多的胆汁随粪便排出,防止身体内的胆汁酸过量积累,从而降低肝脏损害和控制严重瘙痒等并发症,曾被FDA授予治疗FDA授予1岁及以上的ALGS和PFIC患者的突破性疗法称号。
原研企业为辉瑞,现由CANbridge Pharmaceuticals Inc, Lumena Pharmaceuticals, Mirum Pharmaceuticals Inc.三家药企参与研发。已于2020年11月30日向EMA提交了上市申请。
另外也有Vivet Therapeutics的VTX-803(用于治疗PFIC3的一种基因疗法)和Qing Bile Therapeutics的QBT-002(一款小分子化学药物,通过阻断IBAT对胆汁酸的回收,降低血液中胆汁酸水平来达到相关疾病症状改善)等几种药品,但研发阶段相对落后。
四、Albireo Pharma研发管线
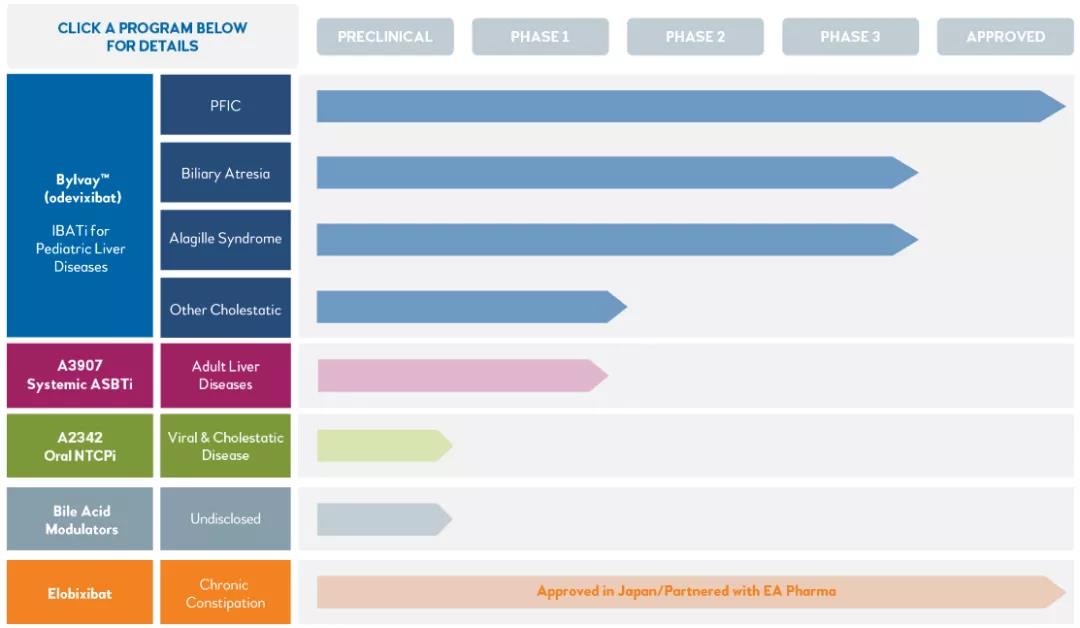
数据来源:Albireo Pharma官网
其中Bylvay™(odevixibat)在美国和欧洲被批准用于治疗 PFIC 的瘙痒症。Elobixivat 在日本和泰国被批准用于治疗慢性便秘。所有其他药物和适应症目前都在研究中。
五、结语
Odevixibat是Albireo Pharma的核心产品,odevixibat作为治疗PFIC的first in class,已在美国和欧盟上市,并有多种适应症处于临III期,Albireo Pharma或将凭借odevixibat一飞冲天!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论