
据药融云数据库统计,2022年10月国内共有114个化药1类新药受理号获CDE承办(含补充申请20个),其中国产85个,进口9个,从申请类型来看,包括临床申请92个,上市申请2个,涉及60个品种,73家企业。
同时,10月共有57个1类治疗用生物制品受理号获CDE承办(含补充申请19个),其中国产31个,进口7个,从申请类型来看,包括临床申请37个,上市申请1个,涉及42个品种,49家企业。
10月共有84款新药获批临床(共计131个受理号),其中包括46款化药,37款生物制品,1款中药;有3款新药获批上市,分别为多格列艾汀片、Selpercatinib胶囊和莫格利珠单抗注射液。(想了解10月完整获批临床新药内容,关注公众号“药融云(yrydate)”,后台回复关键词“报告”即可领取药融咨询《2022年10月全球在研新药与靶点月报》)。
2022年10月国内获批临床新药一览表(部分)
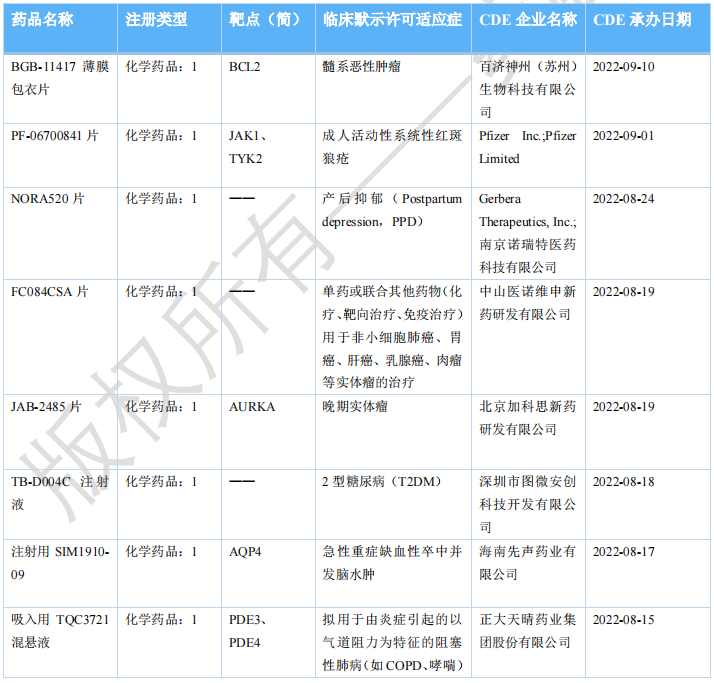
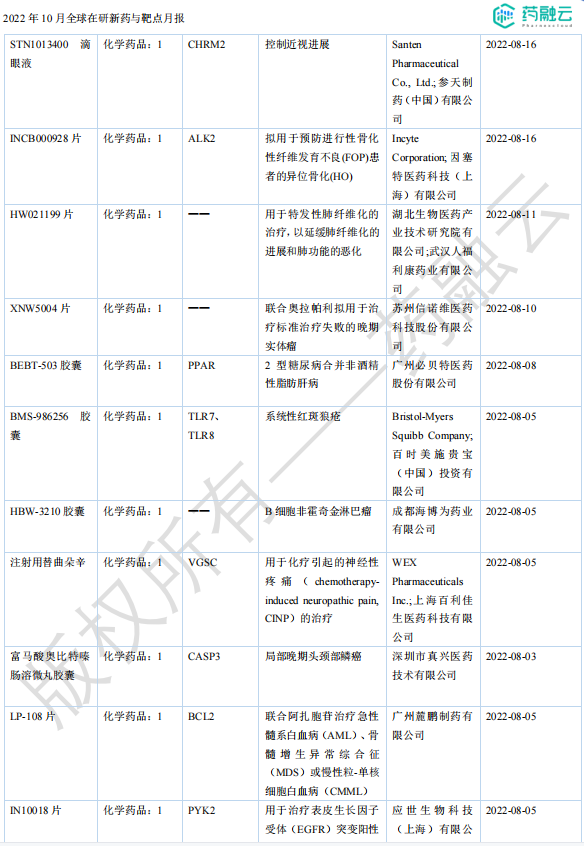
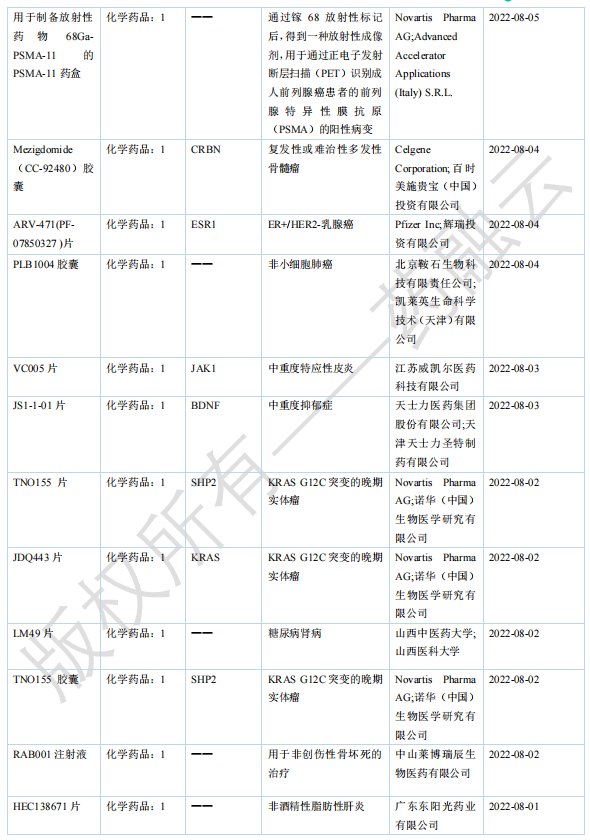
图片来源:药融咨询《2022年10月全球在研新药与靶点月报》
注:此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。
1.全球首创GKA类新药——多格列艾汀片
多格列艾汀片(商品名:华堂宁)是华领医药自主研发的1类创新药,适用于改善成人2型糖尿病患者的血糖控制。多格列艾汀(dorzagliatin)是全球首个提交NDA申请的葡萄糖激酶激活剂类(GKA)糖尿病治疗药物,成为了在中国首先上市的全球GKA类首创(First-in-class)新药,打破了全球首创新药开发的国外垄断。(《全球首个葡萄糖激酶激活剂!华领医药多格列艾汀片国内获批上市》)
多格列艾汀片是全新作用机制的口服抗糖尿病药物,具备五大创新特点:新概念,新疗效,新机制,新结构和新技术,它的获批为我国糖尿病领域再添治疗全新手段,为2型糖尿病患者提供了新的治疗选择。值得一提的是,多格列艾汀片从临床前试验到Ⅰ期、Ⅱ期、Ⅲ期临床试验再到上市,整个过程都由中国科学家、临床专家和中国企业主导完成。
多格列艾汀片审评时间轴(部分)
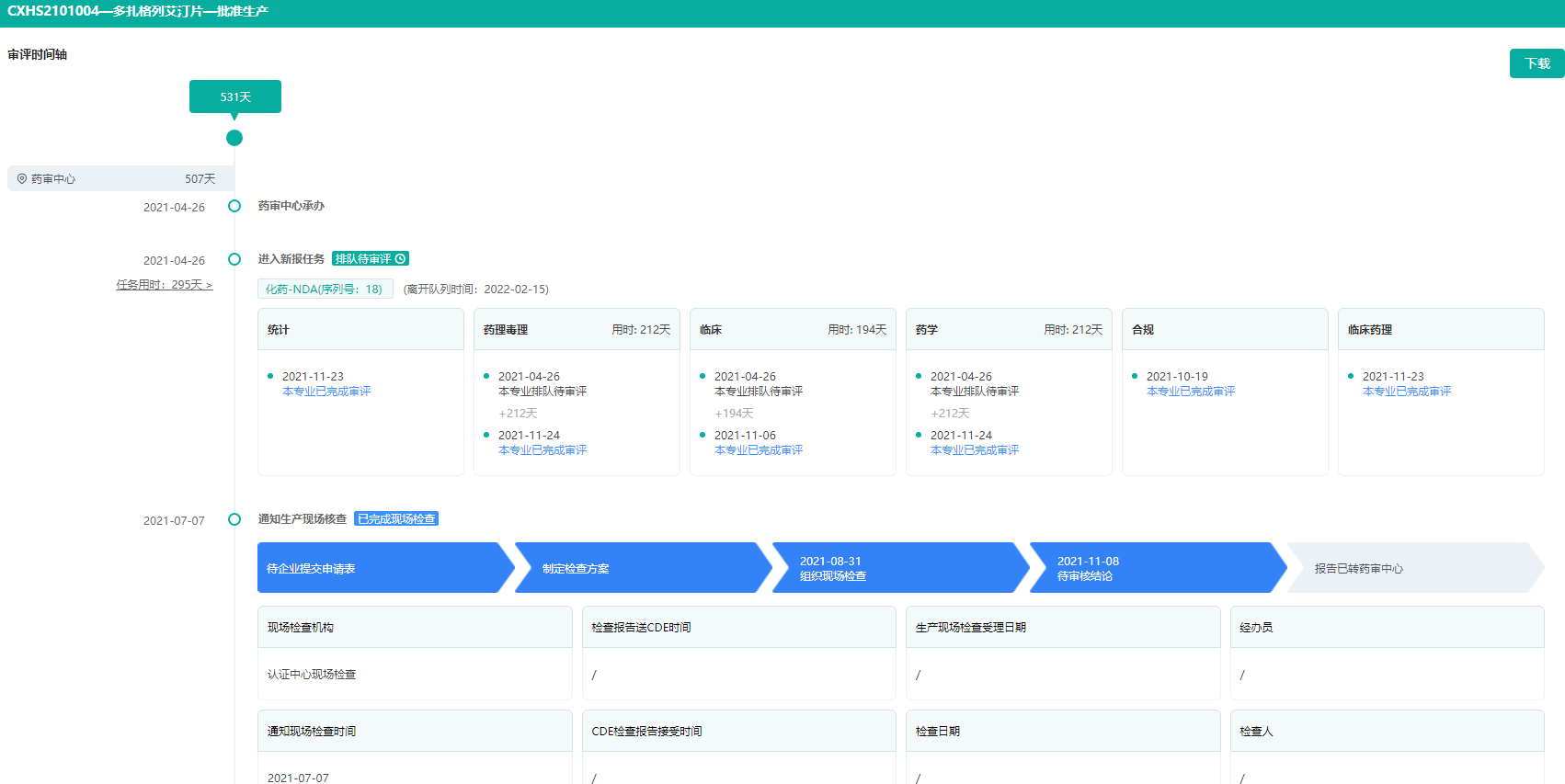
图片来源:药融云中国药品审评数据库
多格列艾汀是一款葡萄糖激酶(GK)激活剂,作用于胰岛、肠道内分泌细胞以及肝脏等葡萄糖储存与输出器官中的葡萄糖激酶靶点,改善2型糖尿病患者受损的葡萄糖刺激的胰岛素和GLp-1分泌,进而改善β细胞功能,减低胰岛素抵抗,从而改善2型精尿病患者血糖稳态失调,具有重塑血糖平衡生理调节的作用机制。
在中国有个说法,“每10个人就有一个人有糖尿病”。中国是糖尿病患者人数最多的国家,2021年我国糖尿病患者达到 1.4 亿。糖尿病危害人体健康,长期病程容易导致视网膜、肾脏、神经系统、心脑血管系统等多个靶器官的损伤,是我国心脑血管事件、终末期肾病、截肢、及失明的主要原因。
同时,在病情严重或应激时可发生急性代谢紊乱如糖尿病酮症酸中毒、高血糖高渗状态等等,可能危及生命。对我国的2型糖尿病患者来说,这些新型药物能在降糖、保护心肾等重要器官的同时,降低药物依从性。
据药融云全球药物研发数据库统计,目前已在国内批准上市的2型糖尿病治疗创新药共计46个,涉及企业26家;其中首家研发TOP10企业有诺和诺德(瑞格列奈+二甲双胍、德谷胰岛素、门冬胰岛素、司美格鲁肽等)、勃林格殷格翰(恩格列净、利格列汀、瑞格列奈等)、赛诺菲(格列美脲、甘精胰岛素)、武田(吡格列酮、伏格列波糖等)、百时美施贵宝(沙格列汀、丙二醇达格列净等)等等。
国内上市的2型糖尿病创新药TOP10企业
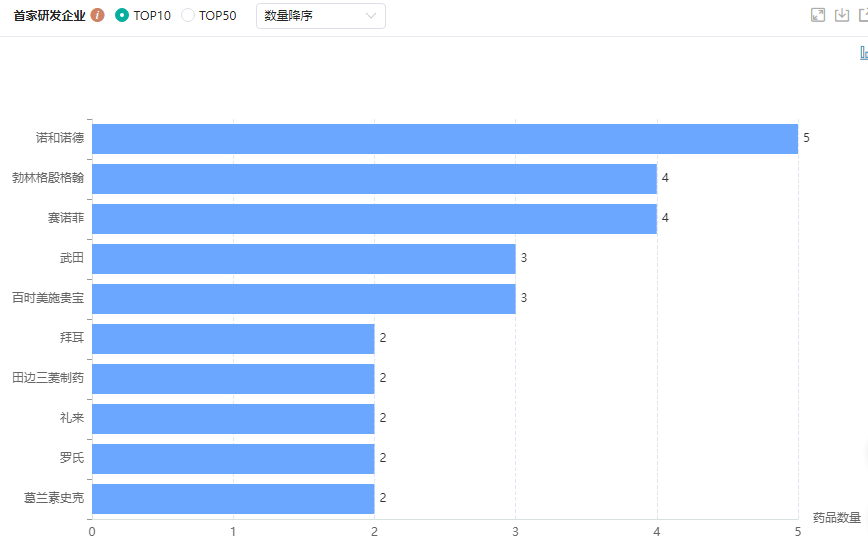
图片来源:药融云全球药物研发数据库
从研发的靶点来看,GLP-1R(胰高血糖素样肽-1受体)、Insulin(胰岛素配体)、DPP-4(二肽基肽酶-4)、INSR(胰岛素受体)、PPARγ(过氧化物酶增殖物激活受体γ)、AMPK(腺苷酸活化蛋白激酶)、PTPN1(PTPN1基因)、SGLT-2(纳-葡萄糖联合转运蛋白-2)等成为热门靶点,竞争激烈。
国内药企的原研新型糖尿病药物,除了多格列艾汀片,还有恒瑞医药的“脯氨酸恒格列净片”、“磷酸瑞格列汀片”,以及微芯生物的“西格列他钠片”。西格列他钠也是全球首个获批治疗2型糖尿病的PPAR全激动剂,其不但可以控制血糖,还可以治疗患者通常因糖尿病而伴发的脂代紊乱和血压异常。
国内糖尿病市场,增长潜力巨大。药融云数据显示,我国糖尿病用药市场规模逐年上升,从2016年的470亿元增长至2019年654亿元,平均增幅达11.6%;2020年市场有小幅度下降至632亿元,同比减少3.36%。
2.“不限癌种”疗法——Selpercatinib胶囊
据药融云中国药品审评数据库显示,10月初,礼来(EliLillyandCompany)在中国申报的selpercatinib胶囊获批上市。Selpercatinib(LOXO-292)是一款RET抑制剂,是礼来公司通过约80亿美元收购LoxoOncology所得。
Selpercatinib胶囊—批准进口审评时间轴
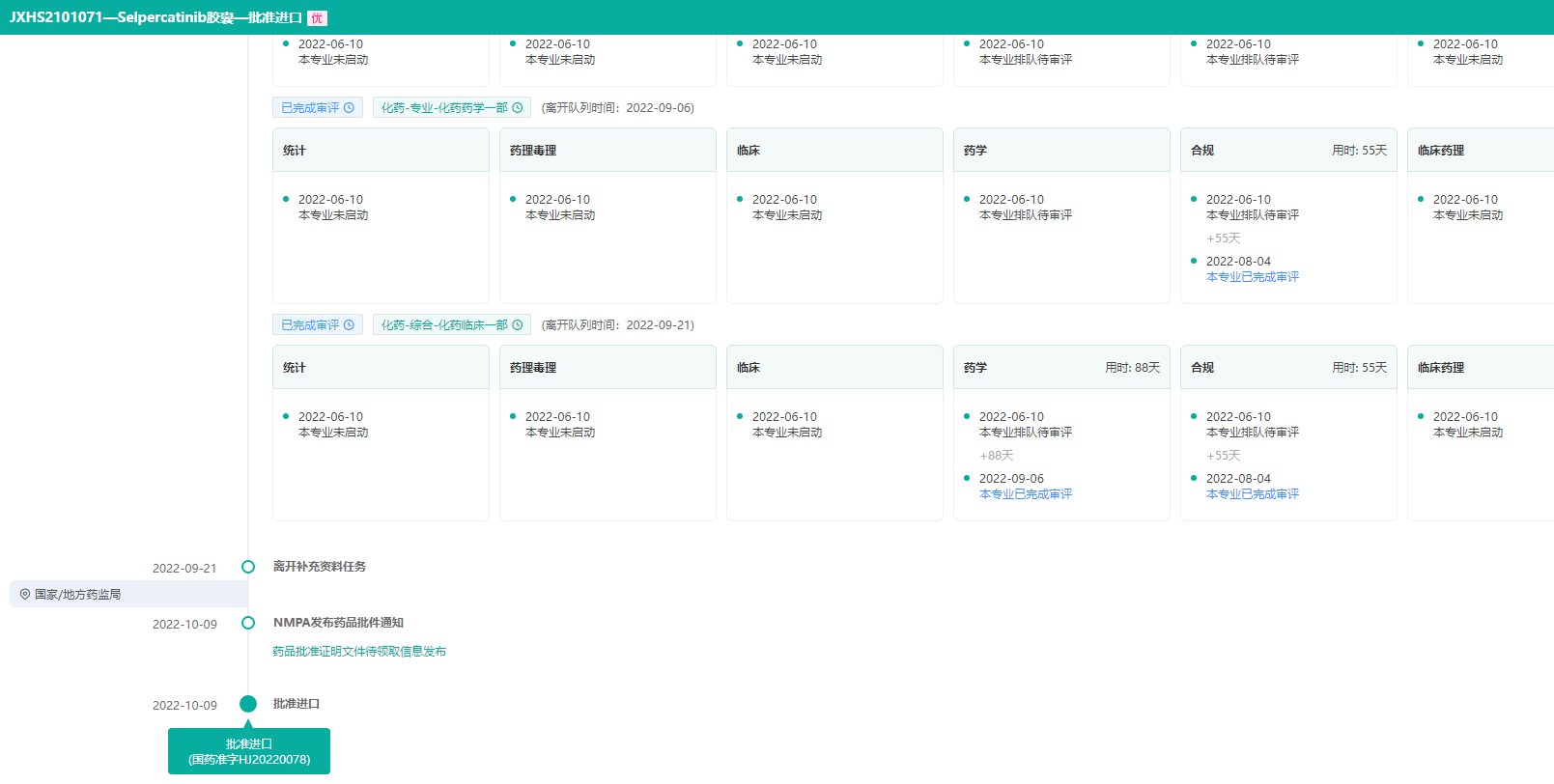
图片来源:药融云中国药品审评数据库
Selpercatinib(商品名:Retevmo)是一种强效、口服、高度选择性转染期间重排(RET)激酶抑制剂,也是首个靶向RET激酶的抑制剂,通过抑制异常RET激酶的活性而发挥作用。于2020年5月在美国获批上市,用于治疗携带RET基因融合或者突变的非小细胞肺癌(NSCLC)、髓样甲状腺癌和甲状腺癌患者。
RET基因变异包括基因融合和激活性点突变,它们可以导致RET信号通路过度激活,细胞生长不受控制。由于RET致癌基因存在于肺癌、甲状腺髓样癌、甲状腺癌、直肠癌、乳腺癌、胰腺癌等多种癌症中,它已成为了“不限癌种”疗法的重要信号通路之一。
携带RET基因变异的癌症主要依靠这一蛋白激酶的异常激活促进它们的增殖和生长,因此这些癌症对RET抑制剂非常敏感。Selpercatinib不但可以抑制天然RET信号通路,也可以抑制可能出现的获得性抗性。
同月,礼来研发的抗血管生成药物雷莫西尤单抗,也在国内获批了新适应症,用于既往接受过索拉非尼治疗且甲胎蛋白(AFP)≥400ng/mL的肝细胞癌(HCC)患者的治疗。肝癌二线治疗再添“猛将”!
雷莫西尤单抗适应症
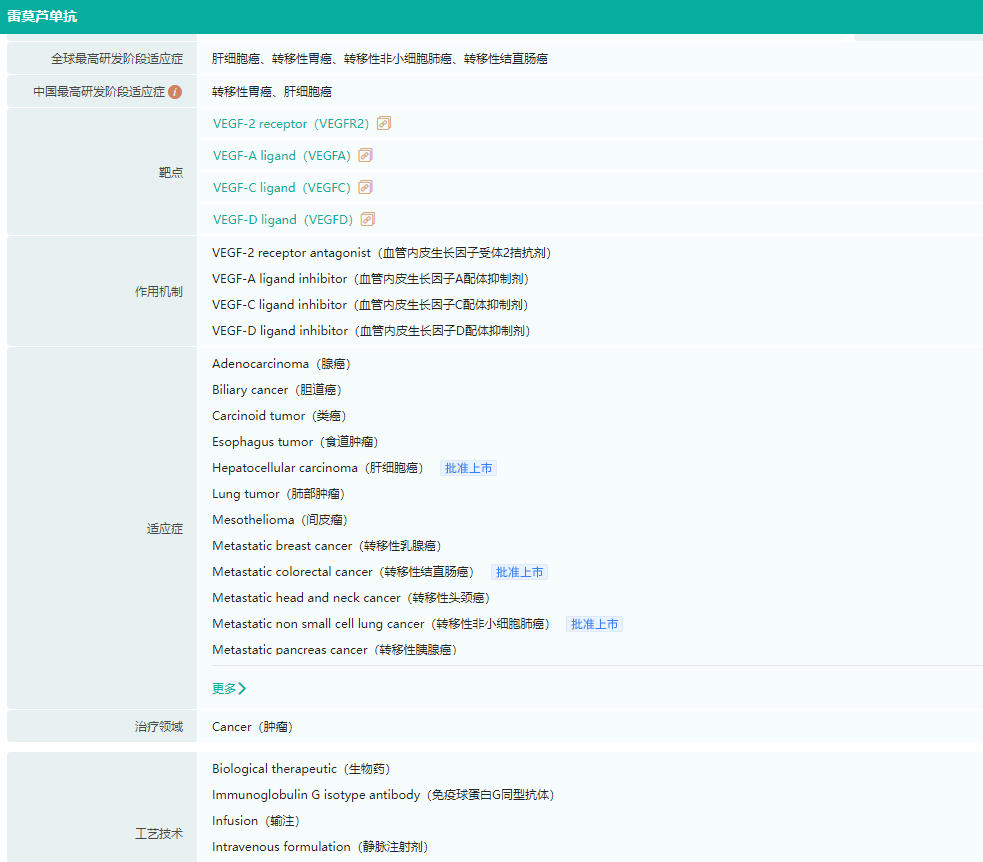
图片来源:药融云全球药物研发数据库
雷莫西尤单抗是一款全人源IgG1单克隆抗体,可与血管内皮生长因子受体2(VEGFR-2)特异性结合,高效阻断VEGF-A与VEGFR-2的结合,亦能够抑制VEGF-C及VEGF-D与VEGFR-2的结合,是国内首个被批准用于晚期胃癌二线治疗的靶向药物。2022年3月,信达生物与礼来公司达成合作,获得雷莫西尤单抗在中国的独家商业化权利。
肝癌是我国的高发瘤种。我国人口不足全球20%,但每年新发肝癌病例却占据全球“半壁江山”。很多患者初诊即是晚期,5年生存率低,疾病负担严重。随着抗肿瘤治疗药物的蓬勃发展,多种新药/新疗法相继问世,为肝癌患者带来了新的曙光。
3.国内首个靶向CCR4生物制剂——莫格利珠单抗注射液
莫格利珠单抗注射液(mogamulizumab,KW-0761)是协和麒麟自主研发的First-in-Class新药,它是一款人源化CC趋化因子受体4(CCR4)单克隆抗体,用于既往接受过至少一次全身性治疗的蕈样肉芽肿(MF)或Sézary综合征(SS)成人患者的治疗。
莫格利珠单抗是国内首个也是唯一获批用于治疗SS和MF的靶向CCR4的生物制剂。据药融云全球药物研发数据库显示,莫格利珠单抗在2012年3月首次在日本获批上市,用于治疗成人T细胞淋巴瘤;2018年8月在美国获批上市,用于治疗塞扎里综合征、蕈样肉芽肿。
莫格利珠单抗上市时间轴&研发状态
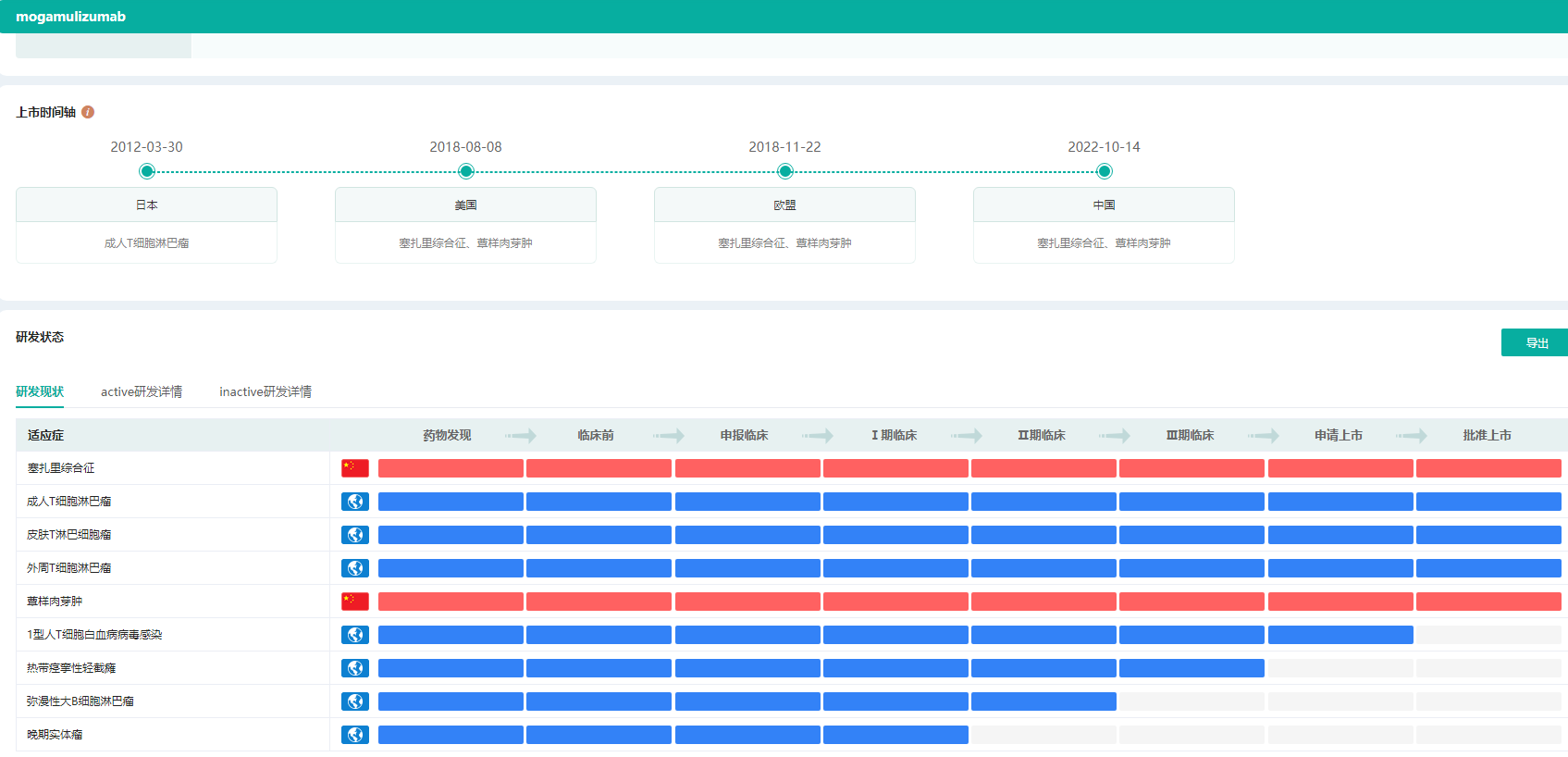
图片来源:药融云全球药物研发数据库
皮肤T细胞淋巴瘤(CTCL)属于罕见型非霍奇金淋巴瘤,SS和MF是皮肤T细胞淋巴瘤最常见的两种亚型,可累及患者皮肤、血液、淋巴结和内脏器官。皮肤T细胞淋巴瘤较罕见,每10万人中约有24名患者,SS和MF两种亚型加起来约占所有皮肤T细胞淋巴瘤病例的65%。
患者普遍生活质量差、误诊率高且晚期缺乏靶向治疗药物,通常会出现皮损、发痒、疼痛以及不可预知的皮肤症状,并可能会导致进一步的并发症,从而影响他们的预期寿命。
由于皮肤T细胞淋巴瘤与湿疹及牛皮癣等常见皮肤病相似,患者平均需要2-7年才能得到确诊。晚期患者的预后明显更差,约半数患者(52%)的生存期仅为5年。莫格利珠单抗的获批上市,将为中国这类患者带来一种全新作用机制的治疗选择。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论