
根据《药融云医药行业观察周报》统计,在2023.02.06-2023.02.12期间,共有83个创新药/改良型新药注册申请获CDE承办(按受理号统计,不含补充申请)。其中,国产药品受理号70个,进口药品受理号13个。
本周共计20款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药12款,生物药8款,无中药。
部分获批临床创新药/改良型新药信息(不含补充申请)
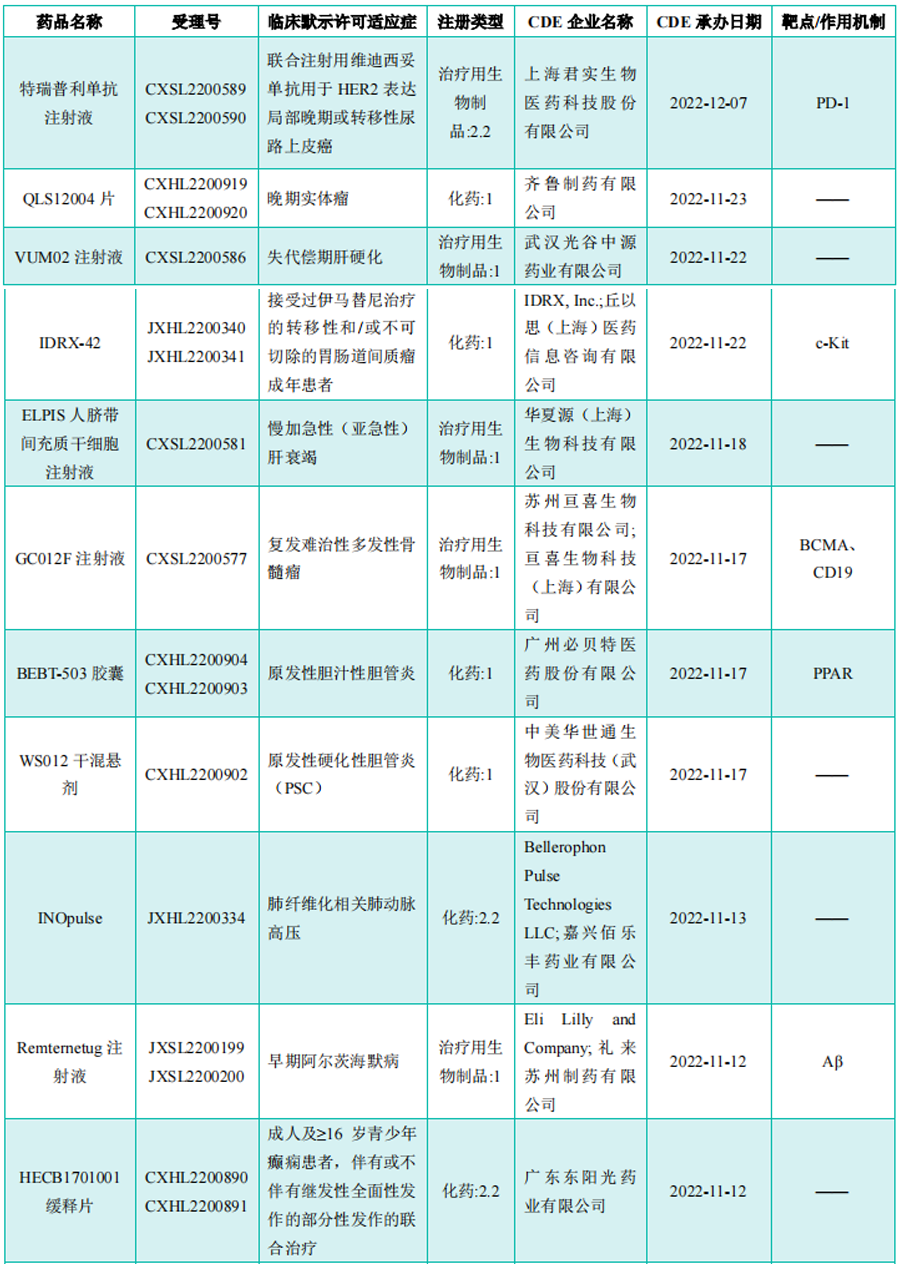
图片来源:《药融云医药行业观察周报》
备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指国家药品监督管理局药品审评中心(CDE)受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过药融云投融资数据库和(或)关注“药融云”公众号(yrydata),后台回复“报告”领取完整周报内容。
其中,本周临床试验申请获得“默示许可”的创新药/改良型新药,值得注意的有:
(1)QLS12004片——1类抗肿瘤新药
QLS12004是齐鲁制药自主研发的1类创新小分子药物,这是该药在国内首次申报临床,拟开展用于治疗包括晚期乳腺癌在内的恶性实体瘤。目前QLS12004靶点尚未公布,但也算拓展了齐鲁制药肿瘤产品线的宽度和深度,为其抗肿瘤领域又增添了一款潜力产品。
据药融云中国药品审评数据库显示,截至目前,齐鲁制药创新管线已有30款1类新药处于申请临床及以上阶段,聚焦肿瘤、感染、肝病、自身免疫等治疗领域,其中大分子生物药有21个,小分子化学药有9个。
2022年,齐鲁制药有超过9款1类新药获批临床,包括注射用QLF32101、QLH11811片、QLH12007片、QL1706射液、QLH11906片、注射用QLS31904、QL1604注射液、注射用QLS31906等。2023年齐鲁制药新药领域也迎来了多项进展,其中有2款1类新药提交了IND申请,分别是QLH12002片和QLP2117注射液。
齐鲁制药临床申请药品TOP10(微信搜索"药融云小程序"进行相关更多数据查询)
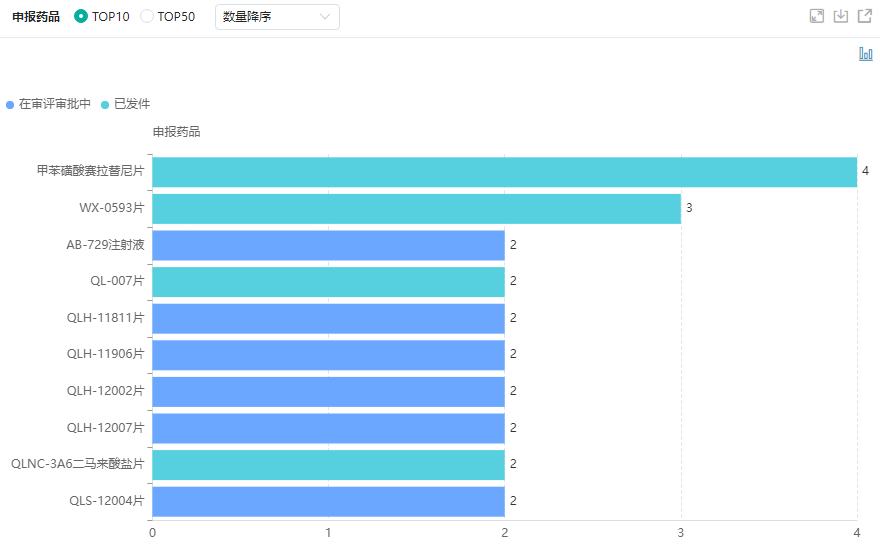
图片来源:药融云中国药品审评数据库
世界卫生组织发布的数据显示,2020年全球乳腺癌新增人数达226万,首次超过肺癌,成为“全球第一大癌症”。而全球乳腺癌药物市场也达到了200亿美元,并且还在不停扩大,预测到2025年复合增长率约11%,将扩大到384亿美元。
(2)注射用贺普拉肽——国内首个丁肝适应症获批临床
上海贺普药业的注射用贺普拉肽获批临床,拟用于慢性丁型病毒性肝炎。药融云数据库显示,贺普拉肽是一款创新HBV(乙肝病毒)进入抑制剂firstin-class原研新药,已于2014年11月获批临床试验,用于慢性乙肝治疗。此次获批的是丁型肝炎,这也是国内企业获得的首个丁肝适应症临床批件。
贺普拉肽通过与HBV肝细胞感染受体NTCP(钠-胆酸转运蛋白)结合,阻断HBV感染,打断现有乙肝治疗中病毒清除到再感染的绵长循环,使健康肝细胞逐渐完成对HBV受染肝细胞的替换。丁肝病毒为乙肝病毒的卫星病毒,利用乙肝病毒的包膜进入到肝细胞,依靠乙肝病毒进行自身复制,没有乙肝病毒就不会发生丁肝。
截至目前,全球约1500万人感染丁肝病毒,流行病学调查研究显示我国丁肝患者约20万人。丁肝患者患肝硬化风险是乙肝的3倍,患肝癌风险是乙肝的9倍,美国FDA认定丁肝是一种威胁生命的严重疾病,欧盟EMA明确指出丁肝存在明显未被满足的临床需求。
注射用贺普拉肽审评时间轴-获批临床耗时86天
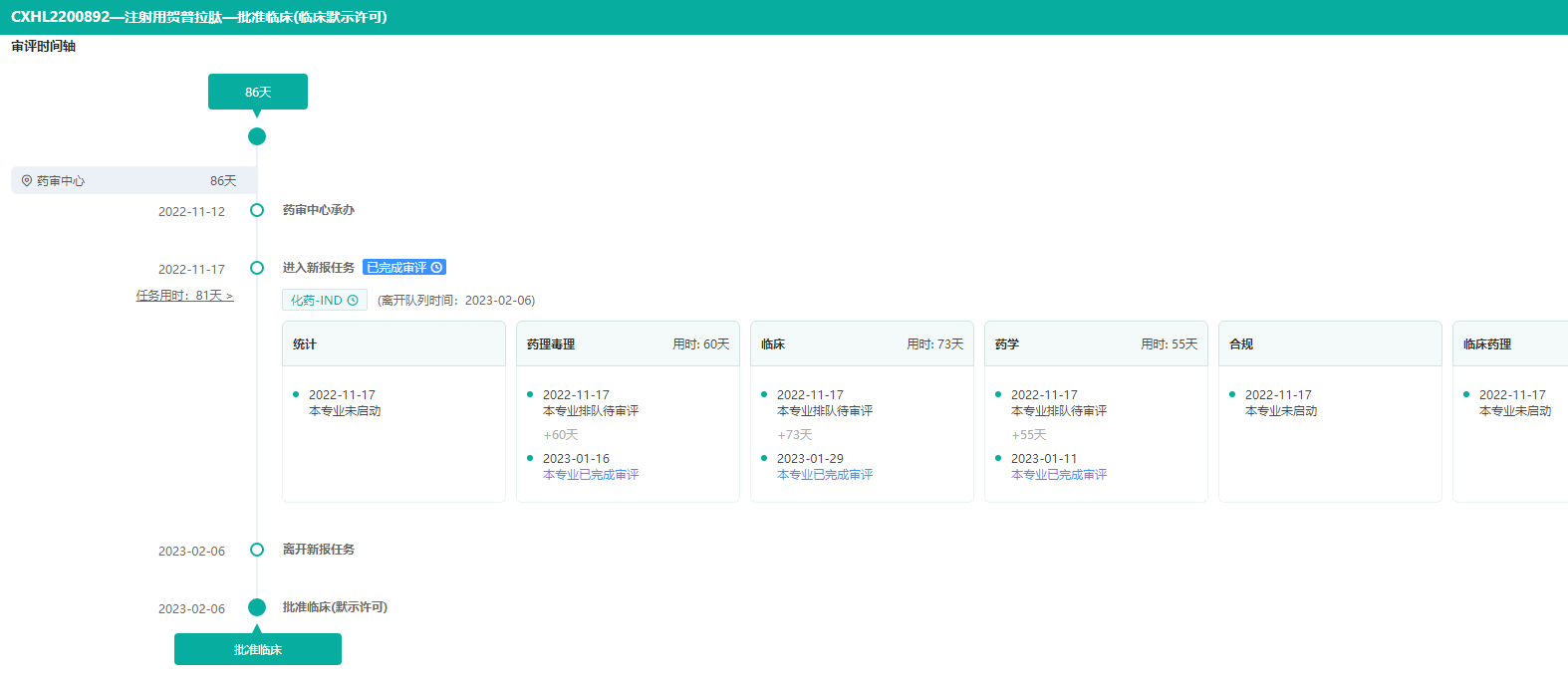
图片来源:药融云中国药品审评数据库
(3)BEBT-503胶囊——活性极强的泛PPARs激动剂
广州必贝特医药的BEBT-503胶囊获批临床新适应症,拟用于原发性胆汁性胆管炎,此前获批开展2型糖尿病合并非酒精性脂肪肝病临床试验。公开资料显示,BEBT-503胶囊是活性极强的泛PPARs激动剂,可有效、均衡地激活PPAR-α、PPAR-β、PPAR-γ三种亚型,调节关键代谢的信号通路,降低原发性胆汁性胆管炎的胆红素水平,减轻肝脏组织炎性细胞浸润、胆管增生和肝细胞坏死程度,抑制肝纤维化。
原发性胆汁性胆管炎(PBC)是一种肝脏的自身免疫性疾病,可导致肝组织的不可逆损伤和瘢痕形成,最终需要肝移植,目前该疾病尚无治愈方法。
据药融云全球临床试验数据库显示,目前,BEBT-503已在澳大利亚开展I期临床试验,初步结果表明其安全性良好。预期BEBT-503将会给原发性胆汁性胆管炎尤其是对熊去氧胆酸应答不佳或无应答的PBC患者带来新的治疗选择。
BEBT-503临床试验(NCT05391880)结果详情
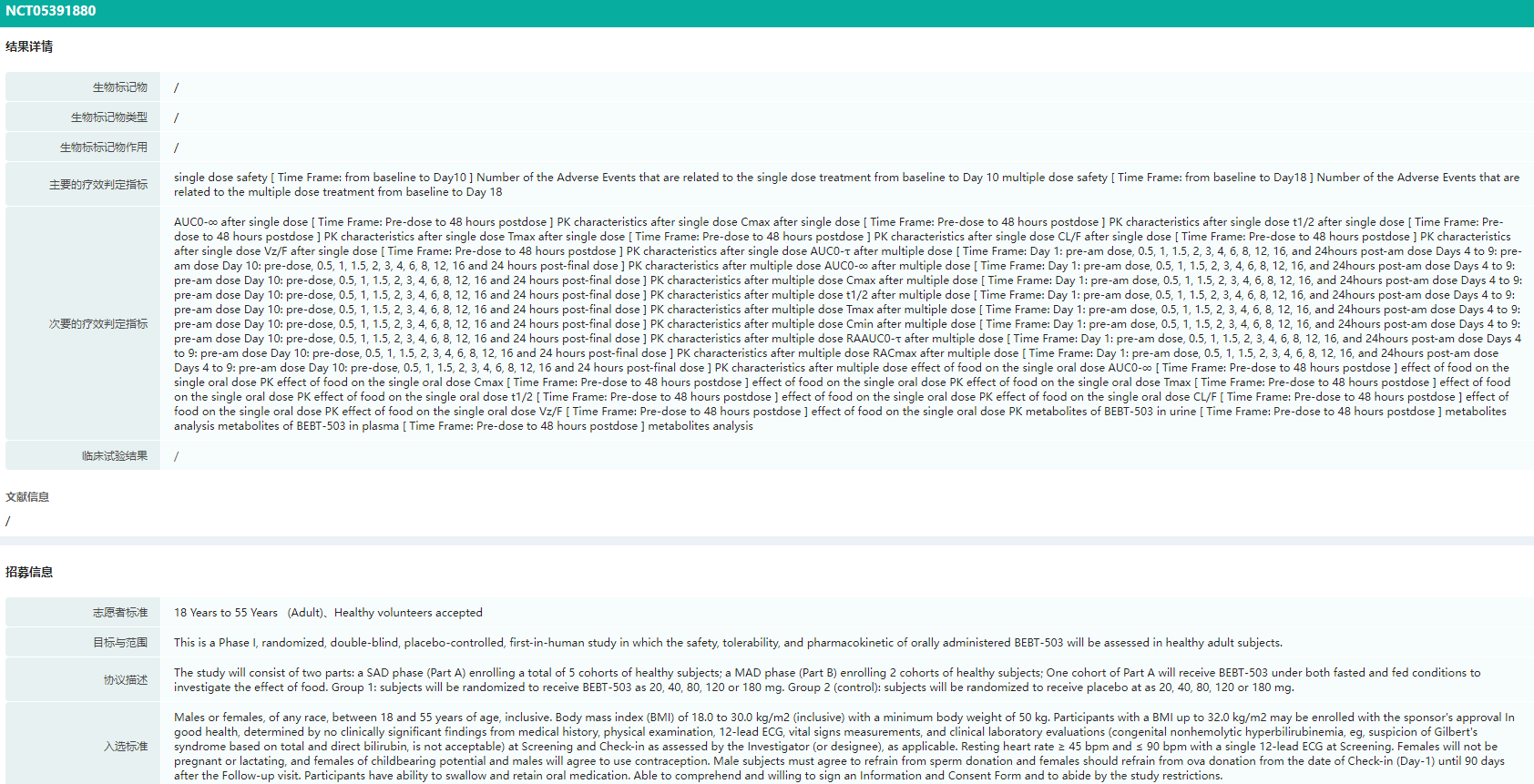
图片来源:药融云全球临床试验数据库
药融云全球药物研发数据库显示,截至目前,必贝特医药有6个自主研发创新药处于临床试验阶段,其中1个处于III期临床试验阶段(CDK4/6抑制剂BEBT-209胶囊,用于治疗晚期乳腺癌),3个处于II期临床阶段(EGFRT70M抑制剂BEBT-109,HDAC/PI3K抑制剂BEBT-908,SM-1),2个处于I期临床阶段(HSP90抑制剂BEBT-305,高选择性ChK1抑制剂BEBT-260)。
(4)VUM02注射液——治疗特发性肺纤维化患者
近日,中源协和全资子公司光谷中源药业的VUM02注射液获批临床,临床拟用于治疗失代偿期肝硬化患者。VUM02注射液是一种冷冻保存型干细胞制剂,是由健康胎儿脐带组织经体外分离、筛选、扩增后制备的人脐带源间充质干细胞(UC-MSC)悬液。
药融云中国药品审评数据库显示,2023年1月5日,VUM02注射液拟用于治疗特发性肺纤维化适应症的临床申请获得了受理。目前全球尚未有用于治疗特发性肺纤维化的同类细胞药物上市,研发进展最快的同类药物处于临床试验阶段。
VUM02注射液获批临床-审评时间轴
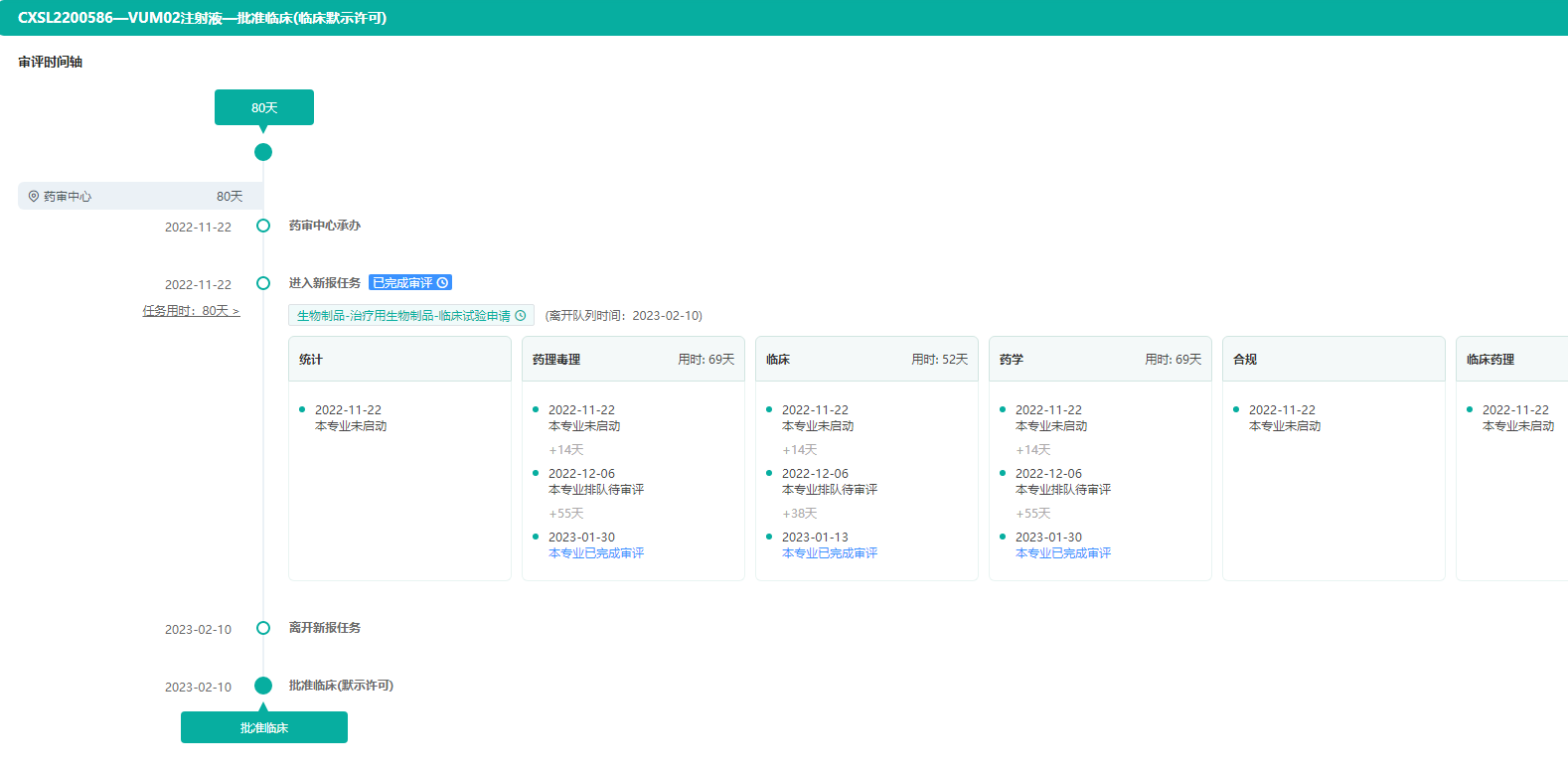
图片来源:药融云中国药品审评数据库
据统计,现阶段我国约有700万肝硬化患者,每年约有4%~12%的肝硬化患者进展为失代偿期肝硬化。2021年我国城市及农村居民肝硬化死亡率分别为4.79/10万人和 5.10/10万人,其中绝大多数是由于发生严重的失代偿事件而导致的死亡。
目前,对于失代偿期肝硬化患者的治疗虽然可以有效延缓患者疾病的进展,但无法完全逆转所有患者的肝脏功能减退。肝移植仍然是治疗失代偿肝硬化最有效的手段。但由于供体肝脏来源缺乏,只有少数患者能得到移植治疗,且价格高昂。所以亟需发展新的具有疗效、安全的治疗产品,以期造福失代偿期肝硬化患者。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入研发时提供数据参考!注册立享15天免费试用!

<END>























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论