1.5.1 本周全球TOP10创新药研发进展
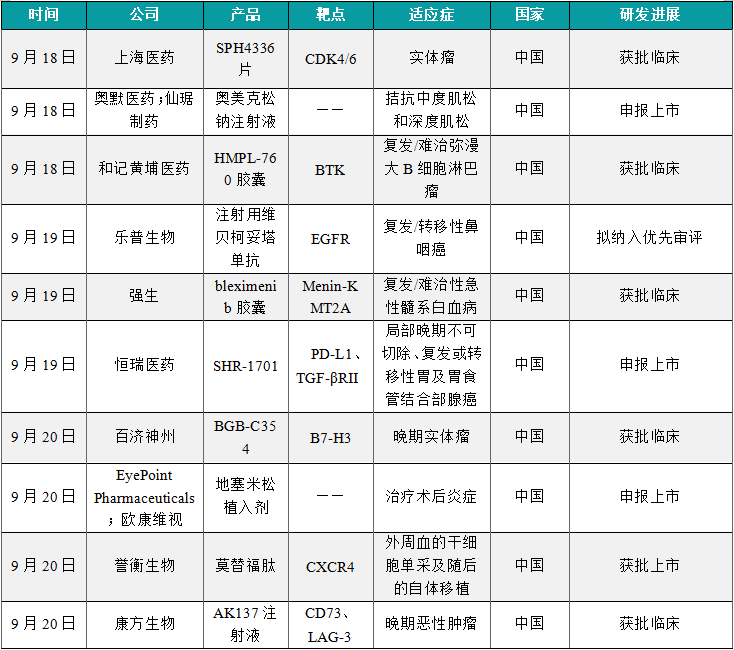
(1)上海医药1类创新药SPH4336片获批临床
9月18日,上海医药申报的SPH4336片获得一项新的临床试验默示许可,拟定适应症为联合奥希替尼治疗KRAS突变型晚期实体瘤。公开资料显示,SPH4336为一款CDK4/6抑制剂,奥希替尼是一种不可逆的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。SPH4336是一种新型高选择性口服抑制剂,具有广谱的抗肿瘤作用。该产品对CDK4/6靶点具有较高的选择性,同时具有广谱抗Rb阳性肿瘤活性。据文献报道,近年来已有研究人员探索CDK4/6抑制剂在KRAS突变型实体瘤中的作用。比如2023年发表在Cancer Res上的一项研究报道,研究人员探索了提高CDK4/6抑制剂在治疗KRAS突变型胰腺导管腺癌(PDAC)中疗效的新策略。
(2)奥默医药/仙琚制药肌松拮抗剂奥美克松钠注射液申报上市
9月18日,由奥默医药和仙琚制药共同申报的1类新药奥美克松钠注射液的上市申请获得受理。根据奥默医药近期新闻稿介绍,奥美克松钠(Aom0498)是其自主研发的新一代靶向肌松拮抗剂。根据中国药物临床试验登记与信息公示平台官网,该产品用于拮抗中度肌松和深度肌松的两项3期临床研究均已完成。据奥默医药公开资料介绍,奥美克松钠(adagammadex)为第二代的靶向肌松拮抗剂。该产品是环糊精类的衍生物经过分子结构的改造,引入了手性基团以屏蔽易引发过敏的羧基,同时强化其特异性,从而降低超敏反应发生等安全性问题。
(3)和黄医药第三代BTK抑制剂新药HMPL-760胶囊再获批临床
9月18日,和记黄埔医药的化学1类新药HMPL-760胶囊获批一项新的临床试验默示许可,适应症为联合R-GemOx(利妥昔单抗+吉西他滨+奥沙利铂)治疗复发/难治弥漫大B细胞淋巴瘤(R/R DLBCL)。公开资料显示,HMPL-760是一款第三代非共价BTK抑制剂,是和黄医药第十一个进入临床开发的潜在创新抗肿瘤候选药物。据和黄医药公开信息,作为一种高选择性、非共价、三代BTK抑制剂,HMPL-760可针对野生型及C481S突变激酶,临床前数据表明,与一代BTK抑制剂相比,HMPL-760具更高的靶点特异性和有效性。BTK的C481S突变在对某些BTK抑制剂产生耐药性中扮演重要角色。
(4)乐普生物EGFR靶向ADC创新药拟纳入优先审评
9月19日,乐普生物注射用维贝柯妥塔单抗拟纳入优先审评,适用于既往经至少二线系统化疗和PD-1/PD-L1抑制剂治疗失败的复发/转移性鼻咽癌患者。根据乐普生物公开资料,这应该是该公司研发的靶向EGFR的抗体偶联药物(ADC),研发代号为MRG003。乐普生物在近日公布的半年报中表示,计划2024年内向NMPA提交MRG003的NDA申请。据乐普生物公开资料介绍,MRG003是一款靶向EGFR的ADC,它由EGFR靶向单抗与强效的微管抑制剂MMAE分子通过vc链接体偶联而成。该药的分子设计使其有潜力扩展至包含更广泛的EGFR过度表达的癌症类型,并且有潜力克服因常见突变导致的多种不同类型耐药。
(5)强生1类白血病新药bleximenib胶囊在中国获批临床
9月19日,强生(Johnson & Johnson)申报的1类新药bleximenib胶囊获批临床,拟用于治疗携带组蛋白-赖氨酸N-甲基转移酶2A重排(KMT2Ar)或核磷蛋白1基因突变(NPM1m)的复发/难治性急性髓系白血病(AML)成人患者。公开资料显示,bleximenib是一款Menin-KMT2A相互作用抑制剂,正在国际范围内开展1/2期临床研究。根据CDE官网查询,本次为该产品在中国首次获批IND。Bleximenib(JNJ-75276617)是一款强效、选择性Menin-KMT2A相互作用抑制剂。临床前研究表明该产品与menin具有独特的结合模式,使其不同于其他的同类产品。根据ClinicalTrials官网,该产品目前正在目前处于1/2期临床研究阶段,作为单药疗法或与其他靶向疗法联合治疗急性白血病。
(6)恒瑞医药SHR-1701申报上市,一线治疗胃癌
9月19日,恒瑞医药宣布其提交的1类新药抗PD-L1/TGF-βRII双功能融合蛋白瑞拉芙普-α注射液(SHR-1701)上市许可申请获中国NMPA受理,本品联合氟尿嘧啶类和铂类药物用于局部晚期不可切除、复发或转移性胃及胃食管结合部腺癌的一线治疗。瑞拉芙普-α注射液是恒瑞医药自主研发的抗PD-L1/TGF-βRII双功能融合蛋白,可以促进效应性T细胞的活化,同时还可有效改善肿瘤微环境中的免疫调节作用,最终有效促进免疫系统对于肿瘤细胞的杀伤。瑞拉芙普-α注射液在胃或胃食管结合部腺癌、直肠癌、非小细胞肺癌等治疗领域现有多项临床研究正在进行,以评估其在各类实体肿瘤中的抗肿瘤作用。
(7)百济神州ADC癌症新药BGB-C354在中国获批临床
9月20日,百济神州1类新药注射用BGB-C354获批临床,拟开发治疗晚期实体瘤患者。公开资料显示,BGB-C354是一款靶向B7-H3的抗体偶联药物(ADC),是百济神州在实体瘤领域布局的一款新分子实体,本次为该产品首次在中国获批临床。BGB-C354是一款靶向B7-H3的ADC,拟开发治疗肺癌和头颈部鳞状细胞癌(HNSCC)。作为B7家族的一个跨膜蛋白,B7-H3在多种癌症中经常过度表达,包括肺癌、前列腺癌、乳腺癌、HNSCC和食管鳞状细胞癌,并且其过度表达与不良预后相关。据ClinicalTrials官网,百济神州此前已经在美国和澳大利亚启动一项1期临床研究,评估BGB-C354单独或与抗PD-1抗体替雷利珠单抗联合用于晚期实体瘤患者的安全性、耐受性、药代动力学和初步抗肿瘤活性。
(8)欧康维视眼科新药地塞米松植入剂申报上市
9月20日,由EyePoint Pharmaceuticals和欧康维视(Ocumension)等联合申报的地塞米松植入剂上市申请已获得受理。这是欧康维视引进的治疗术后炎症的新药OT-502(商品名:DEXYCU)。它是一种新型、可生物降解的单次注射的缓释抗炎药物,可在注射后即刻释放活性成分地塞米松发挥抗炎作用,持续释放21-22天。该产品此前在中国的3期临床研究已经达到主要终点。该药物利用Verisome药物输送技术将地塞米松递送至眼前房,直接抑制前房内炎症介质的合成和释放,能在术后持续、稳定地抑制前房炎症反应,避免频繁使用激素滴眼液,有效解决了部分白内障患者术后用药依从性不佳的严重问题,为白内障术后炎症管理提供更好的选择。
(9)誉衡生物CXCR4拮抗剂莫替福肽获批上市
9月20日,誉衡生物宣布靶向趋化因子受体4(CXCR4)的多肽类药物莫替福肽(APHEXDA®,motixafortide)近日获得中国澳门特别行政区药物监督管理局正式批准上市。该产品用于在多发性骨髓瘤(MM)患者中联合粒细胞集落刺激因子(G-CSF)动员造血干细胞,用于外周血的干细胞单采及随后的自体移植。莫替福肽已于2023年9月获美国FDA批准上市,为一款用于MM患者的创新干细胞动员剂。据誉衡生物新闻稿介绍,莫替福肽的批准是基于GENESIS全球多中心3期注册研究的结果,该研究旨在比较莫替福肽+G-CSF与安慰剂+G-CSF在自体干细胞移植(ASCT)前接受造血干细胞动员的MM患者中的安全性和有效性。
(10)康方生物双抗1类癌症新药AK137注射液获批临床
9月20日,中国国家药监局药品审评中心(CDE)官网最新公示,由康方生物申报的1类创新药AK137注射液获批临床,适应症为晚期恶性肿瘤。公开信息显示,AK137注射液是一款CD73/LAG-3双特异性抗体。此次为这款在研新药首次在中国获批临床。据公开渠道查询,目前全球以CD73或以LAG-3为靶点的在研新药已经处于后期临床研究阶段,但尚无同时靶向CD73及LAG-3的双抗新药获批临床。此次AK137注射液获批临床,意味着康方生物即将启动这款CD73/LAG-3双抗在研药物用于晚期恶性肿瘤治疗的临床研究。
1.5.2本周全球TOP10积极/失败临床结果
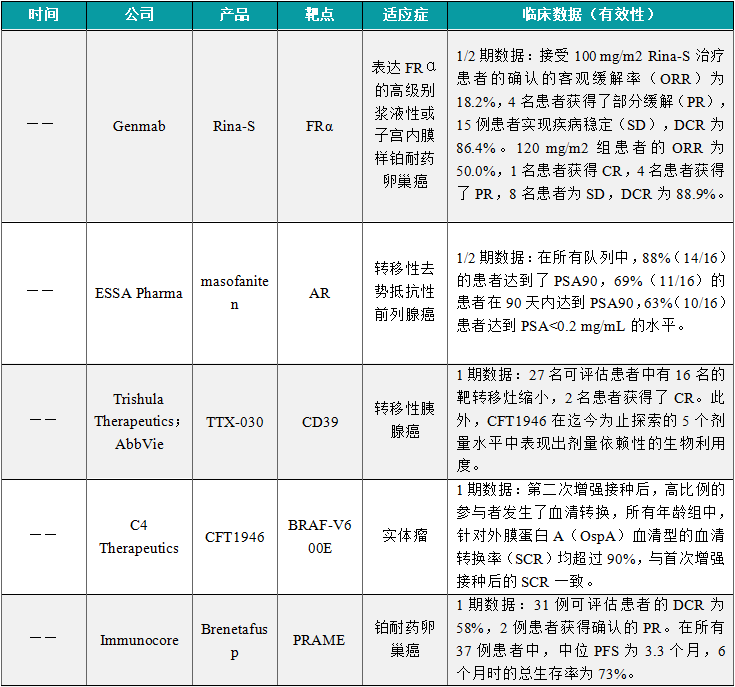
(1)Genmab公司公布其抗体偶联药物Rina-S的1/2期临床结果
近日,Genmab公司公布了其靶向FRα的抗体偶联药物Rina-S的1/2期临床试验数据。Rina-S旨在治疗比第一代FRα靶向ADC更广泛的患者群体。研究的B部分将42名既往接受过治疗的经组织学或细胞学确诊的晚期卵巢癌(上皮性卵巢癌、原发性腹膜癌或输卵管癌)的患者随机分配接受100 mg/m2 Rina-S(n=22)或120 mg/m2 Rina-S(n=20)治疗。接受100 mg/m2 Rina-S治疗患者的确认的客观缓解率(ORR)为18.2%,4名患者获得了部分缓解(PR),15例患者实现疾病稳定(SD),DCR为86.4%。120 mg/m2组患者的ORR为50.0%,1名患者获得CR,4名患者获得了PR,8名患者为SD,DCR为88.9%。基于这些结果,Rina-S 120 mg/m2剂量已被选定在2024年开始的针对晚期卵巢癌患者的3期临床试验中进行进一步评估。
(2)ESSA Pharma公布masofaniten联合疗法1/2期临床数据
近日,ESSA Pharma公司公布了其第二代抗雄激素药物masofaniten(EPI-7386)与恩杂鲁胺联合治疗转移性去势抵抗性前列腺癌患者的1/2期临床试验的新数据。Masofaniten是一种高选择性的雄激素受体N-末端结构域的口服小分子抑制剂。研究结果显示,该组合疗法32个给药周期测试的剂量水平下耐受性良好。无论患者先前的化疗状态如何,包括接受低于全剂量(120 mg)恩杂鲁胺的患者在内,mCRPC患者的PSA都有快速、深度且持久的降低。在所有队列中,88%(14/16)的患者达到了PSA90,69%(11/16)的患者在90天内达到PSA90,63%(10/16)患者达到PSA<0.2 mg/mL的水平。中位随访时间为15.2个月时,PSA进展的中位时间以及影像学无进展生存期尚未达到。
(3)Trishula Therapeutics公布与艾伯维联合开发的TTX-030的 1期临床数据
近日,Trishula Therapeutics公司公布了其与艾伯维(AbbVie)合作开发的抗CD39抗体TTX-030一线治疗转移性胰腺癌患者的1期临床试验结果。该1期临床试验评估了TTX-030+吉西他滨/白蛋白结合型紫杉醇联合使用±budigalimab(一种在研PD-1抗体)作为胰腺癌一线治疗的效果。在可评估疗效的人群(n=57)中,92%为一线转移性胰腺癌患者,8%为局部晚期不可切除患者,ORR为30%,其中3名患者获得了CR。中位无进展生存期(PFS)为7.5个月,中位总生存期(OS)为19.1个月。在28名高表达免疫相关生物标志物HLA-DQ的患者中,ORR为46%,中位PFS为9.6个月,中位OS为21.9个月。
(4)C4 Therapeutics公布小分子降解剂CFT1946的1期临床数据
近日,C4 Therapeutics公司公布了其小分子降解剂CFT1946治疗携带BRAF V600突变的实体瘤患者的1期临床试验数据。CFT1946可以直接降解突变BRAF蛋白,消除其蛋白支架的功能,从而彻底规避RAF信号的异常激活。研究结果显示,27名可评估患者中有16名的靶转移灶缩小,2名患者获得了CR。此外,CFT1946在迄今为止探索的5个剂量水平中表现出剂量依赖性的生物利用度。在迄今为止收集的所有可用的治疗后活检样本中,均观察到BRAF V600E蛋白的降解。安全性方面,CFT1946具有良好的耐受性和安全性,支持其作为单一疗法以及与MEK和EGFR抑制剂联用进行进一步的临床开发。
(5)Immunocore公布brenetafusp的1期临床数据
近日,Immunocore公司公布了brenetafusp在铂耐药卵巢癌患者中的1期数据。IMC-F106C是一种通过ImmTAX平台开发,靶向PRAME抗原的双特异性蛋白。该研究中,37例既往接受过大量治疗(中位线数为5线)的浆液性卵巢癌患者接受了 brenetafusp单药治疗,大多数患者既往接受过贝伐珠单抗(81%)和PARP抑制剂(59%)。31例可评估患者的DCR为58%,2例患者获得确认的PR。在所有37例患者中,中位PFS为3.3个月,6个月时的总生存率为73%。在可评估循环肿瘤DNA(ctDNA)的29例患者中,31%获得了分子学缓解。Brenetafusp联合化疗的安全性与每种单独药物的预期特征一致。13例可评估患者的DCR为69%,3例患者获得PR。在可评估ctDNA的11例患者中,82%获得了分子学缓解。
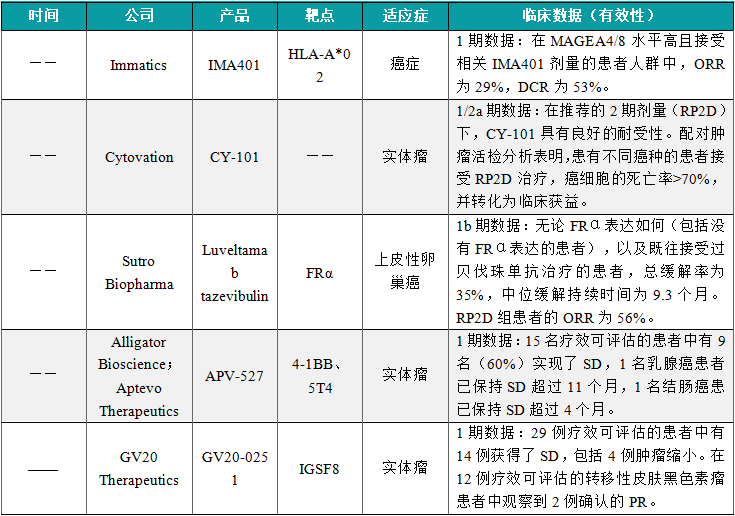
(6)Immatics公布IMA401的1期临床数据
近日,Immatics公司公布了其下一代半衰期延长的T细胞受体(TCR)双特异性抗体平台的首个候选药物IMA401的1期临床数据。分析显示,IMA401单药治疗具有初始抗肿瘤活性和可控的耐受性。患者群体包括35名既往接受过大量治疗的患者,共涉及16种不同的实体瘤类型。在MAGEA4/8水平高且接受相关IMA401剂量的患者人群中,ORR为29%,DCR为53%。此外,在头颈部鳞状细胞癌、神经内分泌肿瘤、皮肤和粘膜黑色素瘤患者中观察到客观缓解,包括长达超过13个月的持久PR和深度缓解(肿瘤缩小≥50%)。药代动力学数据表明,IMA401的中位半衰期为16.9天,支持当前的每两周一次的给药方案和未来延长至四周一次的给药方案。
(7)Cytovation公布CY-101(CyPep-1)的1/2a期临床数据
近日,Cytovation公司公布了其双功能免疫疗法CY-101联用抗PD-1疗法帕博利珠单抗治疗晚期实体瘤的1/2a期临床试验结果。CyPep-1是一种独特的、高度差异化的合成肽疗法,它具有独特的双重作用机制,既能通过激活Axin2抑制Wnt/β-catenin致癌通路,还能通过释放新抗原激活全身性肿瘤特异性免疫反应。结果显示,在推荐的2期剂量(RP2D)下,CY-101具有良好的耐受性。配对肿瘤活检分析表明,患有不同癌种的患者接受RP2D治疗,癌细胞的死亡率>70%,并转化为临床获益。值得注意的是,在接受CY-101单药治疗的6例肾上腺皮质癌患者中,观察到DCR为50%,2例患者缓解超过6个月。这两名患者均表达β-catenin,且Wnt/β-catenin通路中发生了体细胞突变。
(8)Sutro Biopharma公布Luveltamab tazevibulin联合疗法的1期临床数据
近日,Sutro Biopharma公司公布了正在进行的luveltamab tazevibulin(luvelta)联合贝伐珠单抗治疗上皮性卵巢癌患者的1b期研究的最新数据。Luvelta是一种FRα靶向ADC,每个抗体含有4个hemiasterlin细胞毒素,能够精确定位并有效递送至肿瘤,同时确保给药后的全身稳定性。研究中,luvelta联合贝伐珠单抗在晚期卵巢癌患者中显示出令人鼓舞的抗肿瘤活性,无论FRα表达如何(包括没有FRα表达的患者),以及既往接受过贝伐珠单抗治疗的患者,总缓解率为35%,中位缓解持续时间为9.3个月。RP2D组患者的ORR为56%。这些早期数据提示luvelta有望作为一种非生物标志物驱动的方法来治疗上皮性卵巢癌患者。
(9)Alligator Bioscience和Aptevo Therapeutics联合公布APV-527的1期临床数据
近日,Alligator Bioscience公司和Aptevo Therapeutics公司公布了APV-527用于治疗可能表达肿瘤抗原5T4的实体瘤患者的1期临床试验数据。APV-527是一种靶向4-1BB和肿瘤抗原5T4的双特异性抗体,仅在与4-1BB和5T4同时结合时才有活性。此次公布的结果显示,15名疗效可评估的患者中有9名(60%)实现了SD,1名乳腺癌患者已保持SD超过11个月,1名结肠癌患已保持SD超过4个月。安全性方面,APV-527在所有队列中均表现出积极的安全性和耐受性,尚未确定最大耐受剂量。
(10)GV20 Therapeutics公布GV20-0251的1期临床数据
近日,GV20 Therapeutics公司公布了其靶向新型免疫检查点IGSF8的抗体疗法GV20-0251治疗实体瘤患者的1/2期研究结果。结果显示,29例疗效可评估的患者中有14例获得了SD,包括4例肿瘤缩小。在12例疗效可评估的转移性皮肤黑色素瘤患者中观察到2例确认的PR。安全性方面,GV20-0251在所有剂量水平下均具有良好的耐受性,未观察到剂量限制性毒性。大多数治疗相关不良事件为1/2级,仅报道1例3级肺炎。
同期事件:
1. 2024年第38周09.16-09.22国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第38周09.16-09.22国内仿制药/生物类似物申报/审批数据分析
3. 2024年第38周09.16-09.22国内医药大健康行业政策法规汇总
4. 2024年第38周09.16-09.22全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.09.16-2024.09.22)},如需查看或下载完整版报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论