
在医药界,有一个广为流传的“双十定律”——即新药研发投入往往远超10亿美元,开发周期长达10年以上,而最终成功上市的概率却不足10%。在这个常态下,任何能从技术上打破“慢”、“贵”、“高风险”瓶颈的路径都格外受到期待。近年来,随着ChatGPT横空出世,让人不禁设想:如果AI能真正承担起“发现靶点+设计分子+优化过滤”的职责,是否可能将新药研发的前期周期、大量失败、资源浪费压缩到可承受的尺度?
但有一个问题一直是怀疑者的拦路虎:到目前为止,几乎没有哪一个AI发现的“全新靶点+全新分子”能真正推进到人体临床阶段,并获得可公开验证的疗效信号。以往一些所谓“AI设计”药物,往往是AI在早期筛选/优化中参与辅助,人为验证占主导。要找到一条几乎从头至临床都靠AI主导的路径,迄今为止只有极少数案例。
在这种背景下,Insilico Medicine 推出的 ISM001-055(后被命名为Rentosertib)显得尤为引人注目。根据公开资料,rentosertib 是世界上第一个在靶点发现+分子生成两端皆由生成式AI平台主导的候选分子,并已进入多中心双盲随机对照的临床2a期试验。2025年6月,其在Nature Medicine发表了中期结果,这标志着AI驱动药物发现首次在临床验证上取得了较为公开的里程碑。
本文即以rentosertib为例,从技术与方法层面分析其研发过程,探讨其在时间、质量、成本等维度相比传统路径的优势与劣势,并在此基础上浅谈AI制药目前的局限与未来突破方向。
一、Rentosertib研发历程
1. 靶点发现与机制假设
Rentosertib的诞生,是Insilico Medicine的Pharma.AI平台两个核心子模块协同作用的结果:PandaOmics(生物学/靶点发现引擎)和Chemistry42(生成式分子设计模块)。两者构成了从疾病到候选药物的完整AI驱动闭环。
Insilico借助PandaOmics模块对来自多源的多组学数据(转录组、蛋白组、单细胞组等)以及文献、专利、临床数据库中的海量记录进行了系统分析。该平台通过自然语言处理(NLP)、图神经网络(GNN)和多维特征融合算法,构建了疾病–基因–通路–药物的综合关联网络。
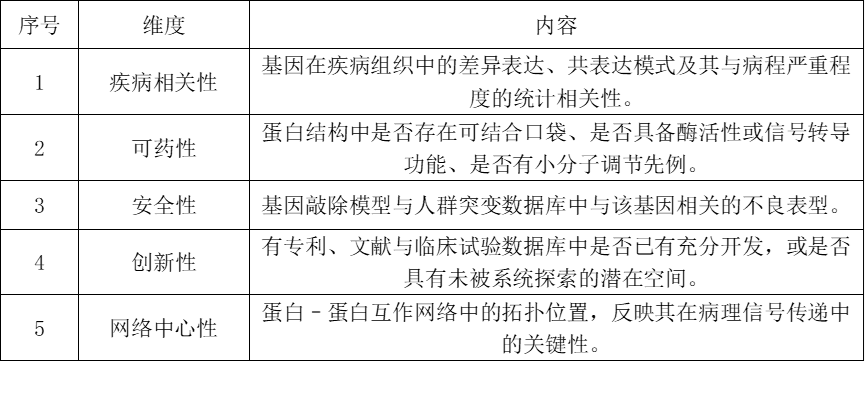
PandaOmics模块综合上述维度进行深入研究及排序、分类,得出一个与组织纤维化密切相关且具有可药性的高分候选靶点即TNIK。Insilico随后采用传统实验路径验证TNIK的功能作用,如表格所述。
根据以上实验基础,Insilico得出TNIK的抑制可显著降低纤维化指标,并具备良好的安全性信号。
2. 分子设计、优化与候选提名

得出靶点后,Insilico借助Chemistry42生成式分子设计。Chemistry42核心框架如上述表格所述。Chemistry42在模型中嵌入了多重约束条件,以确保分子在药物开发路径上的综合可行性。
主要评估维度如下:
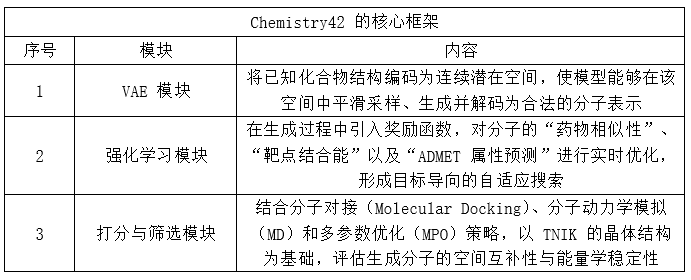
通过上述多层维度打分过滤筛选,Chemistry42 在极短时间内生成并筛选出数百个候选分子。最终,Insilico只合成测试了少于80个分子,就确定了 ISM001-055(Rentosertib)作为临床前候选药物。随后,他们启动了一套系统的体内外验证流程——包括体外活性评价、药代动力学与安全性评估,以及功效模型验证等多个环节,逐步推进验证候选药物的初步疗效。
3. 临床实验
(1)在早期临床阶段,Insilico 进行了 Phase 0 微剂量试验(microdose)与 Phase I 试验(在新西兰和中国)验证安全性/药代动力学(PK)特性。公开披露称,在健康受试者中 7 天给药后未见显著累积性,且PK表现良好。
(2)2023年4月,Insilico启动 ISM001-055 的 Phase IIa随机、双盲、安慰剂对照试验(注册号 NCT05938920),共71名特发性肺纤维化(IPF)患者,分组接受placebo、30mg QD、30mg BID、60mg QD 四种方案,为期 12 周。
(3)在2024年11月,Insilico 公布初步topline结果:该药在所有剂量组均耐受良好、不良反应以轻至中度为主(最常见为腹泻和肝功能异常,各约 14.8%)。疗效指标上,所有给药组均表现出剂量相关的肺功能改善(以 FVC 为主要指标)。在最高剂量60mgQD组,平均FVC较基线改善98.4 mL,而对照组平均下降62.3mL。
(4)2025年6月,《Nature Medicine》发表了 Rentosertib(ISM001-055)在特发性肺纤维化(IPF)患者中的Ⅱa期临床结果。研究在中国22个中心共纳入71例患者,随机接受不同剂量Rentosertib或安慰剂治疗12周。结果显示,高剂量组(60 mg QD)患者的肺活量(FVC)平均改善约98 mL,而安慰剂组下降约20 mL,提示潜在疗效信号。治疗相关不良事件发生率与安慰剂相近(约70–83%),多为轻中度,主要为肝功能异常和腹泻,整体耐受性良好。
综上:现有IPF(特发性肺纤维化)的标准治疗药物主要为尼达尼布和吡非尼酮,二者虽能延缓疾病进展,但无法逆转已有的肺功能损伤。据Insilico公司公布的数据,Rentosertib 在临床中显示出良好的安全性和耐受性,并表现出改善患者肺功能的积极趋势,有望阻止甚至逆转肺纤维化进程,但目前入组人数较少,还需进一步验证临床疗效。
二、传统创新药研发和AI创新药研发对比
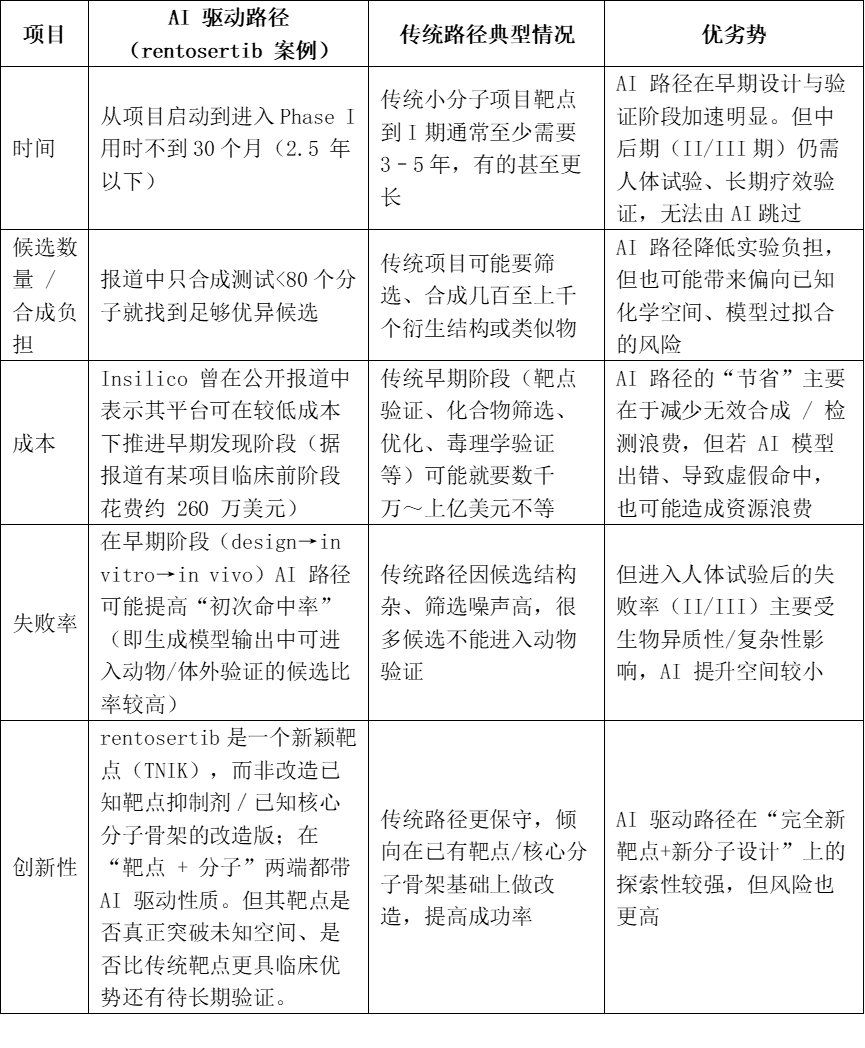
综上:AI制药在早期阶段具备加速、节省资源、缩减负担的优势;但在临床成功率、长期安全性、真实疗效等方面,其优势尚不明显,且仍面临重大风险。
三、浅析AI制药的局限性、成因与突破方向
1. 数据质量与可用性
(1)局限性
① 公开数据库中的靶点-化合物活性、ADMET 和毒性数据往往不完整、且因实验条件和标准不一(如不同检测方法、实验室)导致一致性差,影响AI模型训练效果。
② 公开的数据多为成功的案例或者易于发表的结果,缺乏失败的案例,影响AI模型过拟合,对于研究较少的靶点或罕见病领域,样本稀缺,很难构建模型。
③ 大量有价值的临床与企业内部数据受隐私限制无法流通,阻碍跨机构验证与模型优化。
④ 数据标注也缺乏统一标准,不同来源在命名、单位、实验条件等方面差异显著,进一步干扰模型学习。
(2)突破方向
大力推广联邦学习和安全计算,在不共享原始数据的前提下进行模型训练;建立行业统一的数据标准和负样本数据库,可以显著提高模型的泛化能力和鲁棒性。
2. 模型可解释性与因果关系
(1)局限性
现有的深度学习模型(尤其是生成式模型)是黑箱,擅长发现相关性,但难以确定药物作用的因果性,比如无法清晰解释“为什么这个分子有效?”或“为什么这个靶点比其他靶点好?
(2)突破方向
积极开发可解释人工智能技术,将AI的预测结果转化为可被生物学家和化学家理解的科学假设;融合知识图谱和因果推断模型,从“相关性”转向“因果性”预测。
3. 复杂生物学环境的模拟
(1)局限性
AI模型在体外表现优异,但在模拟复杂的人体环境、特别是疾病的生物异质性、多靶点通路和动态毒性方面存在明显不足。因为单一Omics数据往往是静态的、单维度的快照,无法全面捕捉活体系统中的动态反馈和多器官间的复杂相互作用。
(2)突破方向
深度整合多组学数据(基因组、蛋白组、代谢组等),构建疾病的数字孪生模型;建立AI-湿实验的闭环研发体系,用实验结果实时反馈和迭代模型,确保虚拟预测的生物学真实性。
四、近期AI制药涌现的新成果(2024-2025)
Rentosertib的成功并非孤例,它点燃了整个行业的加速探索,AI制药已从“概念验证”阶段,进入了“大规模临床管线”阶段。
(1)管线数量爆发与品类拓宽:截至2025年,全球已有数十款AI驱动的药物候选物进入临床试验,品类已不再局限于小分子,正向大分子、肽类、抗体甚至细胞疗法延伸。例如,阿斯利康等大型药企正与AI平台合作,利用生成式AI加速大环肽类药物的发现,特别是针对自身免疫和代谢疾病等慢性病领域。
(2)GenAI赋能精准医疗:新一代生成式AI(如大语言模型)开始被用于解读患者的基因图谱和临床数据,推荐最有效的治疗方案。它能够辅助医生进行患者分层和个性化剂量优化,从而最大限度地减少传统试错式用药,提高临床试验效率和药物上市后的疗效。
(3)深度学习驱动靶点验证:越来越多的公司利用AI平台在肿瘤学、神经退行性疾病和罕见病领域发现新型或“难以成药”的靶点,为后续的药物设计提供全新方向。AI正在从一个“分子设计工具”升级为“生物学发现引擎”。
五、总结
我们相信AI可以显著提高医药领域的质量和效率,只不过目前处于初始阶段,当前的局限(如数据孤岛、黑箱模型、生物复杂性)是技术发展中的必然阵痛,只要一个个解决技术发展中难题,必然显著爆发。
届时,AI制药将不再是简单的加速工具,而是医学研究的基础操作系统。药物研发的周期将进一步压缩,成本将大幅降低,创新性将呈几何级增长。对于人类医学而言,这意味着针对癌症、阿尔茨海默病、纤维化等复杂疾病的治疗方案将大面积爆发,真正实现定制化、精准化的未来医疗图景。
六、参考文献
[1] Xu Z , Ren F , Wang P ,et al.A generative AI-discovered TNIK inhibitor for idiopathic pulmonary fibrosis: a randomized phase 2a trial[J].Nature Medicine[2025-10-30].DOI:10.1038/s41591-025-03743-2.
[2] Ren F, Aliper A, Chen J, et al. A small-molecule TNIK inhibitor targets fibrosis in preclinical and clinical models[J]. Nature Biotechnology, 2025, 43(1): 63-75.
[3] Ghislat G, Hernandez-Hernandez S, Piyawajanusorn C, et al. Data-centric challenges with the application and adoption of artificial intelligence for drug discovery[J]. Expert Opinion on Drug Discovery, 2024, 19(11): 1297-1307.
[4] Pharmaceutical Industry News (2024-2025). Reports on recent AI drug partnerships (e.g., AstraZeneca/YuanSi Bio-Peptide) and the general trend of AI drug candidates entering Phase I/II trials.
扩展阅读:
2. 颠覆认知!研究发现更强大的免疫系统可能会阻碍癌症的免疫治疗
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论