全球已知的约七千种罕见病,在中国影响着数千万人。一张名为“罕见病目录”的国家清单,正成为这片“医疗无人区”的希望灯塔。摩熵咨询最新发布的《2025全球罕见病行业发展报告:政策演进、市场趋势与领先企业布局》,不仅为我们勾勒出全球罕见病领域的宏观图景,更提供了剖析政策演进、市场趋势与企业布局的关键视角,是理解这一复杂生态系统的必备指南。其中对罕见病行业的全景式梳理,清晰勾勒出这一特殊领域的核心特征与发展现状。
1. 政策导向下的定义差异:全球罕见病管理格局
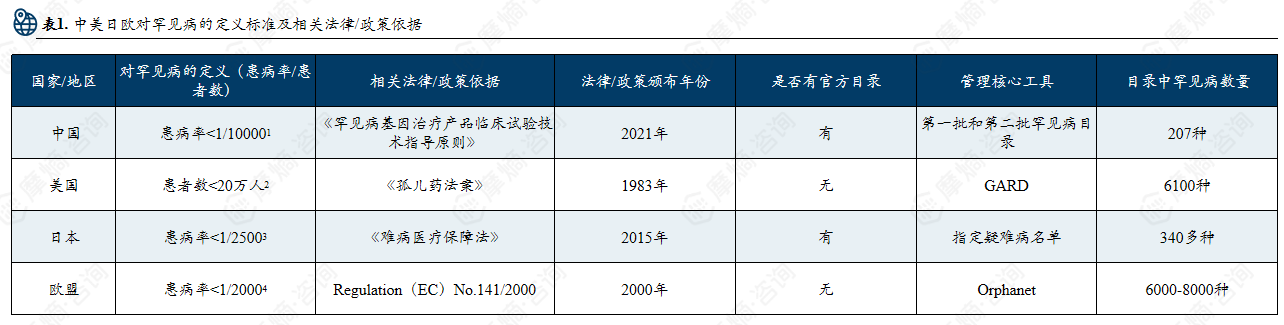
中美日欧罕见病管理格局:各国对罕见病的定义有差异,中国按照目录管理,已有207种疾病纳入罕见病目录。
罕见病(rare disease)又称罕见疾病,是指在极少数人身上发生的稀罕病症,所以也称孤儿病。不同国家对罕见病的认定标准存在一定差异,我国尚无明确的定义,但是世界上已经确诊的罕见病就已经有近7000种,并且其中有80%都是遗传性疾病。
罕见病的治疗药物也被称为孤儿药(Orphan drug)。罕见病的药物研究成本高昂,受众相对常见病较少,药物开发往往难以收回成本,因此仅有少数企业愿意投身罕见病药物的开发,造成了药物种类的稀缺,且罕见病用药价格昂贵。 当前,我国罕见病药物的可及性仍处于较低水平。
中美日欧各国对于罕见病的定义并非是统一的医学概念,而是政策导向的结果。美国以“患者人数”为核心,日本以“医保可负担性”为核心,欧盟强调“跨国协同”,中国起步较晚仍处于“目录建设+登记体系完善”的阶段。
美国以“患者人数”为核心标尺,通过1983年《孤儿药法案》确立了以市场规模为导向的认定体系;日本以“医保可负担性”为评判核心,在医疗资源配置与患者保障间寻求平衡;欧盟强调“跨国协同”,通过区域性协作机制实现疾病认定的统一与互认;而中国起步较晚,正致力于构建“目录管理+登记体系完善”的发展模式,通过国家罕见病目录确定纳入保障的疾病范围并由政府主导更新,现已将207种疾病纳入目录管理。
在罕见病目录建设上,各国同样采取了不同管理模式。美国没有统一目录,而是通过 GARD公开数据库管理相关疾病和药物信息;日本以难病法为基础建立难病名录,由学会和政府共同评估并纳入医保补助;欧盟未设统一目录,但通过 Orphanet 数据库进行疾病信息管理。
中美日欧对罕见病的定义标准及相关法律/政策依据
2. 患者规模与区域差异:全球罕见病流行病学图谱
中美日欧罕见病患者规模与管理现状:罕见病影响全球上亿人口,欧盟患者数量居首,中国患者超 2000 万,登记系统待完善,数据与管理体系仍存在短板。
罕见病虽单病种发病率低,但海量病种叠加形成了庞大的患者群体,全球受罕见病影响的人口已上亿。在各国现有定义框架下,患者规模呈现明显的区域差异:其中欧盟罕见病患者数量居全球之首,约3000万人;美国受影响人数约2500万;中国罕见病患者超过2000万,是全球重要的患者群体之一;日本官方尚未公布具体数据,但根据Orphanet全球比例推算,其患者数量大致在440万至740万之间。
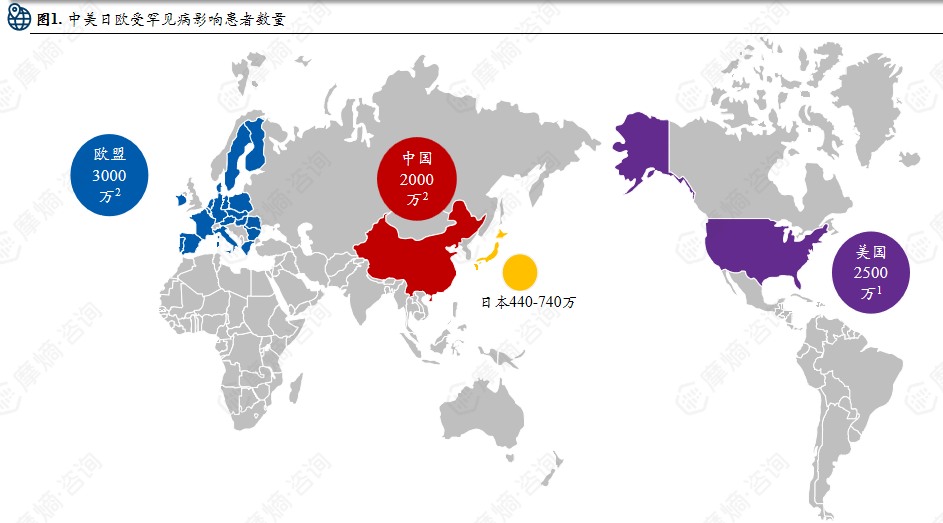
图片来源:摩熵咨询《2025全球罕见病行业发展报告》
具体到中国,罕见病管理仍面临诸多待完善之处。从流行病学特征来看,我国罕见病以先天性与遗传性疾病占比高为显著特点,同时存在整体确诊率偏低的问题——患者确诊周期长、误诊率较高,且诊疗资源分布不均衡,一线城市的诊疗水平与资源储备明显优于中西部地区。
在核心的患者管理环节,国家罕见病登记系统尚处于建设与完善阶段,相关流行病学数据来源多元但准确性有待提升,与欧美国家成熟的GARD、Orphanet管理体系相比仍存在一定差距。
3. 罕见病药物可及性:从“孤儿”到“曙光”的跨越
中美日欧罕见病药物可及性:中国国内用药覆盖率超六成,美国累计获批数量最多,2024年中国新批药物数量领先但总量仍有差距,罕见病用药从“孤儿”到“曙光”。
(1)第一批、第二批罕见病全球及国内药物可用性情况
146种(70.5%)罕见病“全球有药”可用,61种(29.5%)罕见病“全球无药”可用。117种(56.5%)罕见病“国内有药”可用,90种(43.5%)罕见病“国内无药”可用;28种(13.5%)罕见病“境外有药,境内无药”可用;12种(5.8%)罕见病是“在国内有药上市但尚未获批相关适应症”的超说明书用药状态。
(2)中国和美日欧罕见病药物获批上市数量对比
- 中国:2018起推出罕见病目录名单,截至到2024年底已有1883种药物获批上市;
- 美国:1983年《孤儿药法案》实施,截至2022年FDA共批准8821种罕见病用药;
- 欧盟:2000年起实施孤儿药制度,已授权超过2604种罕见病用药上市;
- 日本:2015年实施《疑难病医疗保障法》,暂无官方统计数据。
2024年中美日欧批准上市药物数量:中国批准55种罕见病药物上市;美国批准26种罕见病药物上市。欧盟批准15种罕见病药物上市;2023年日本批准22种罕见病药物上市。
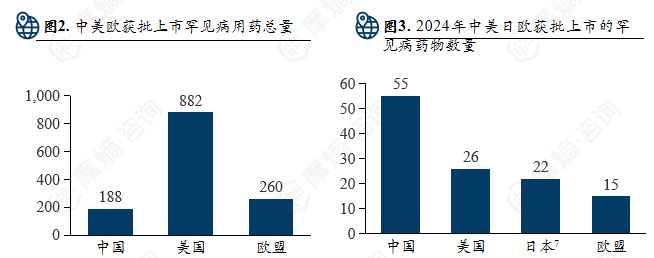
美国累计获批罕见病用药最多(882+),而欧盟(260+)也远高于中国当前的获批准总量。
(3)中国当前罕见病药物可及性受限影响因素
高价药物治疗负担重,即使纳入医保仍有“用不起药”的情况。多数罕见病未全覆盖医保,医保支付政策尚不完善。国内本土研发管线正在增长,但与国际大型制药企业在罕见病创新药研发实力上仍存在一定差距。
正如IQVIA临床运营经理所言:“罕见病往往缺乏可选治疗方案,在无药可治的情况下,患者反而更愿意参与新的临床试验。做罕见病相关业务的公司是有情怀的,因为病人少,药物上市后受众少,利润低。”这份情怀与现实的张力,恰是中国罕见病产业必须跨越的沟壑。
4. 结语
从定义标准到患者规模,从药物可及到产业生态,罕见病行业在挑战中孕育着变革的力量。摩熵咨询的这份《2025全球罕见病行业发展报告》中,不仅让我们看到了全球药企的布局与竞争,更看到了全球患者命运的改变。当政策、资本与情怀形成合力,罕见病这片曾经的“医学荒地”,终将成为生命科技创新的沃土。
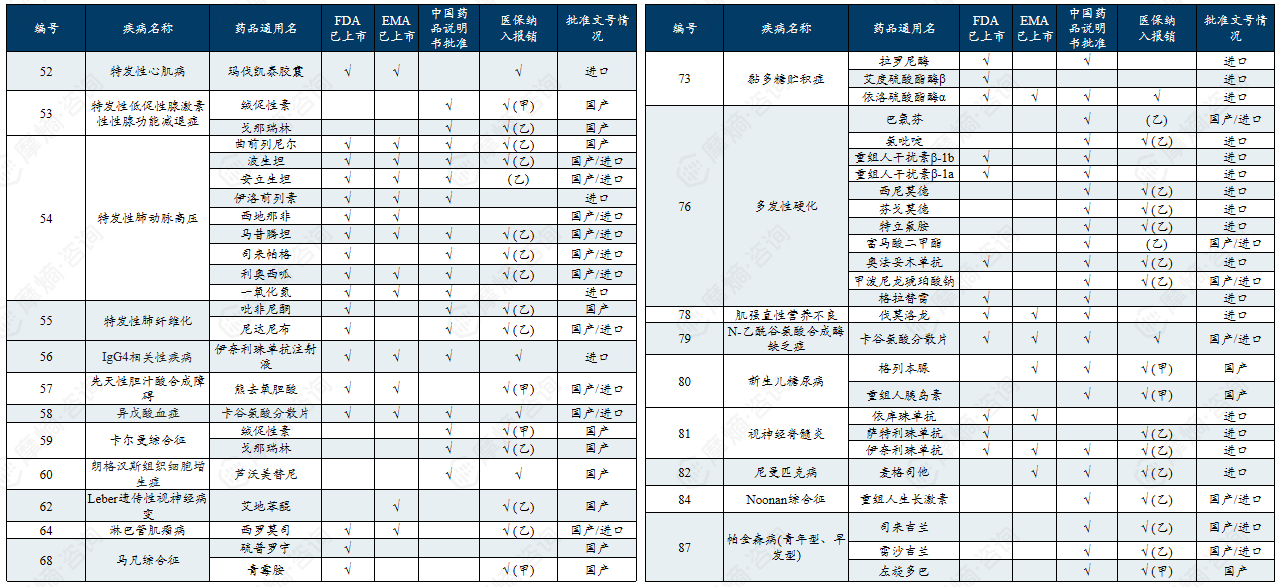
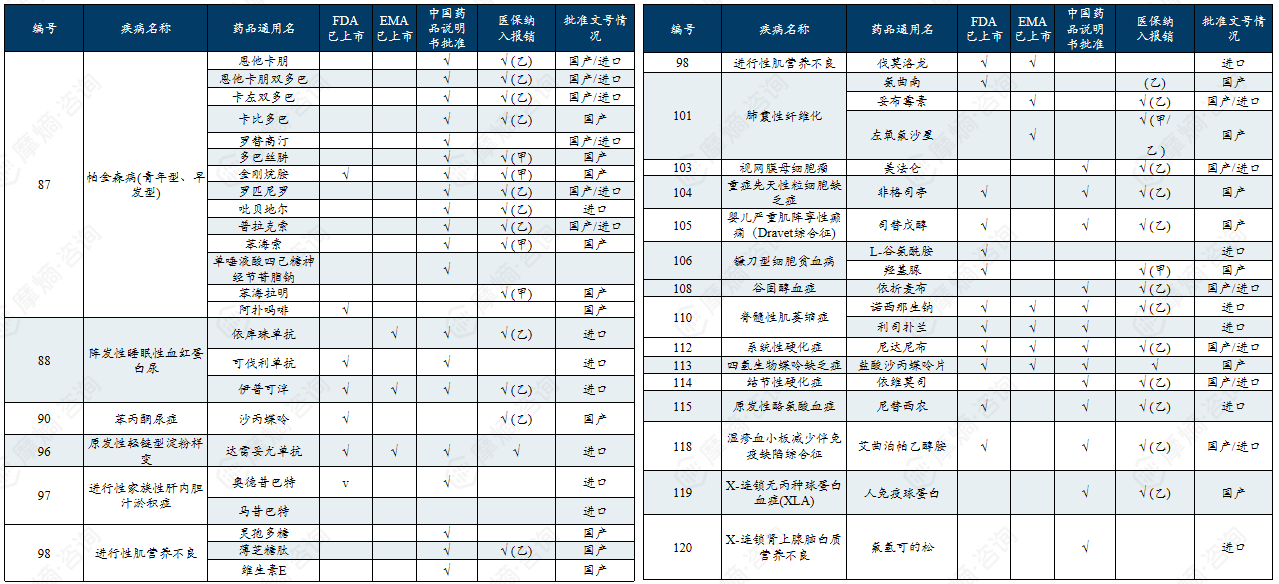
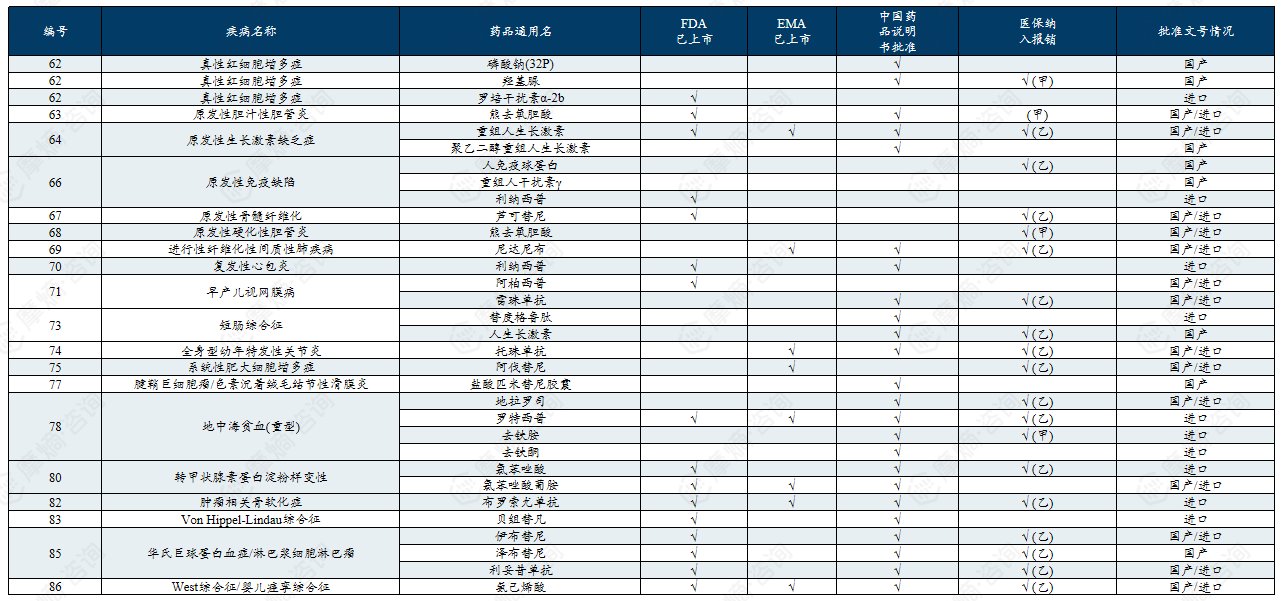
附录:中国第一/二批罕见病目录有药可用疾病
中国第一批罕见病目录有药可用疾病列举
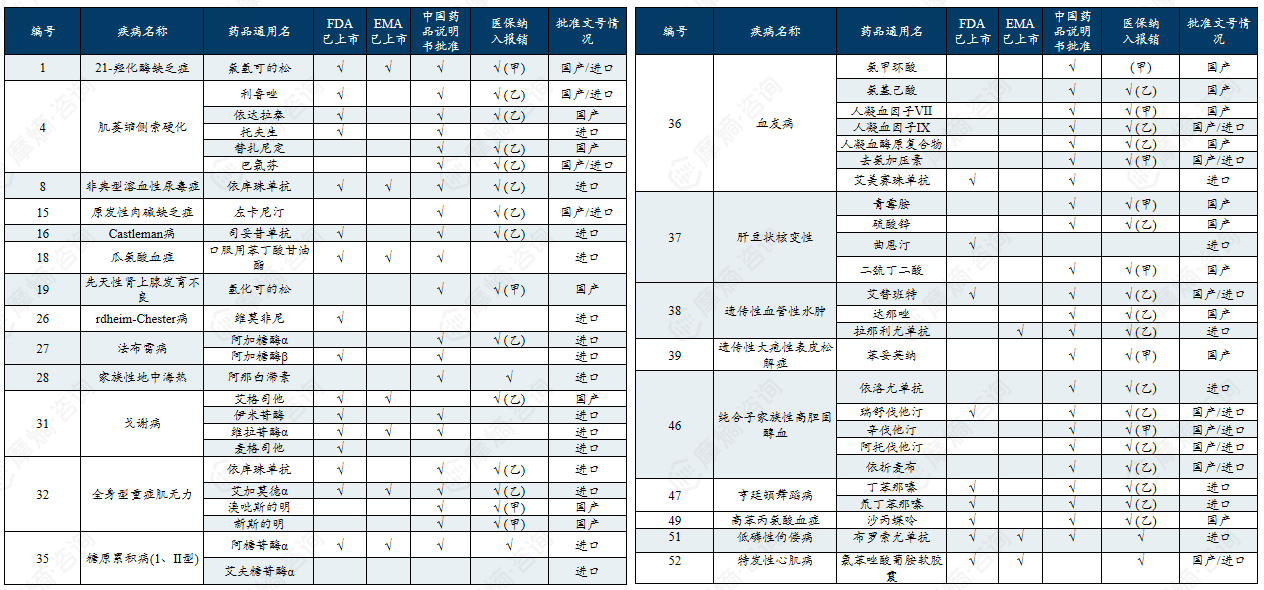
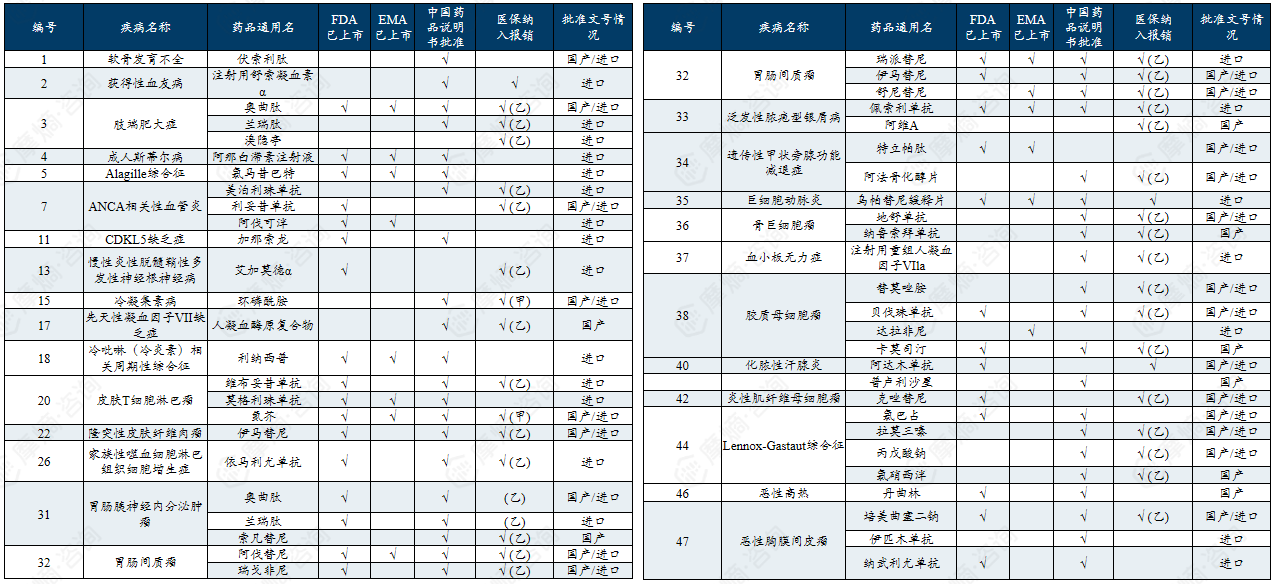
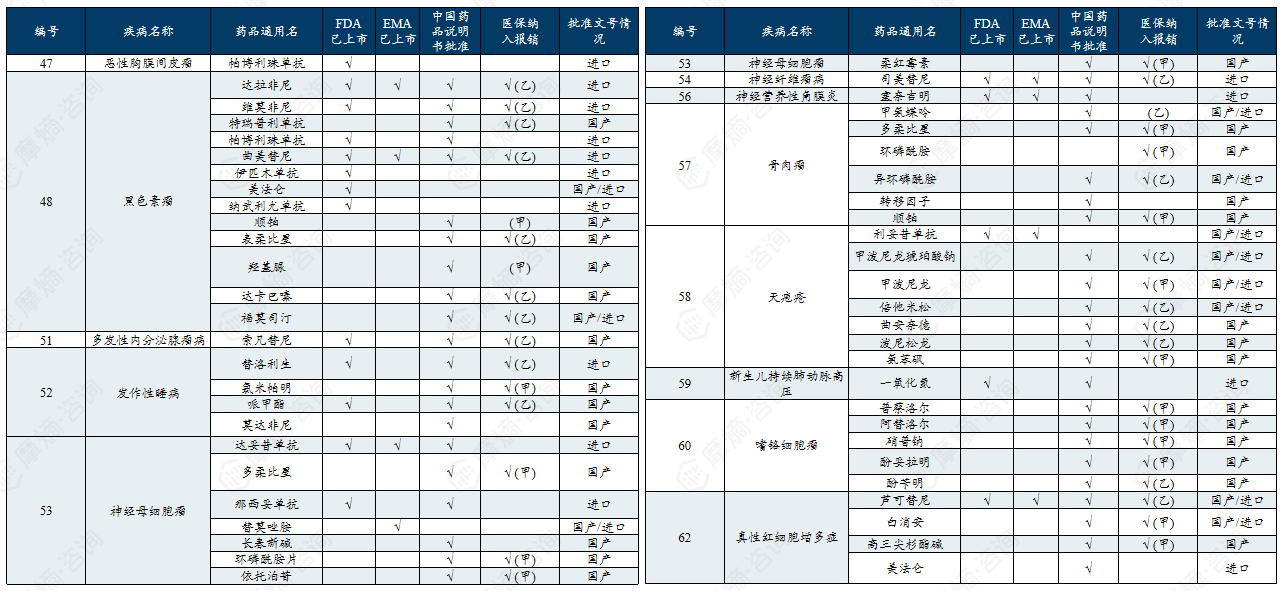
中国第二批罕见病目录有药可用疾病列举
拓展阅读:
1. 2026年罕见病政策分析:中、美、日、欧如何破解药物研发与可及性难题?
2. 2025年全球五大热门研发罕见病:黑色素瘤、胶质母细胞瘤、多发性硬化...
3. 全球罕见病领域药物研发Top5企业揭秘:诺华“砸钱”扩张与辉瑞“王牌”保卫战
4. 全球罕见病领域药物研发TOP5企业:勃林格殷格翰、赛诺菲、BMS...
以上内容均来自 摩熵咨询《2025全球罕见病行业发展报告:政策演进、市场趋势与领先企业布局》,如需查看或下载完整版报告,可点击!
查数据,找摩熵!想要解锁更多疾病领域信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握疾病领域涉及药物信息、销售情况与各维度分析、市场竞争格局、创新药研发情况、仿制药布局情况、最新进展、市场规模与前景等,以及帮助企业抉择可否投入仿制与研发时提供数据参考!注册立享15天免费试用!
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论