
转眼间2022年已过了近七个月,中国NMPA的新药审评工作也取得了不错的成绩,多款新药陆续登陆中国,给患者带来了新的治疗方式。据药融云统计,截至2022年7月25日,国内一共批准了28款新药,包含17个小分子化学药、10个生物药、1个中成药。(7月25日,真实生物的阿兹夫定片获批用于新型冠状病毒肺炎,为新适应症获批,不纳入此次统计)
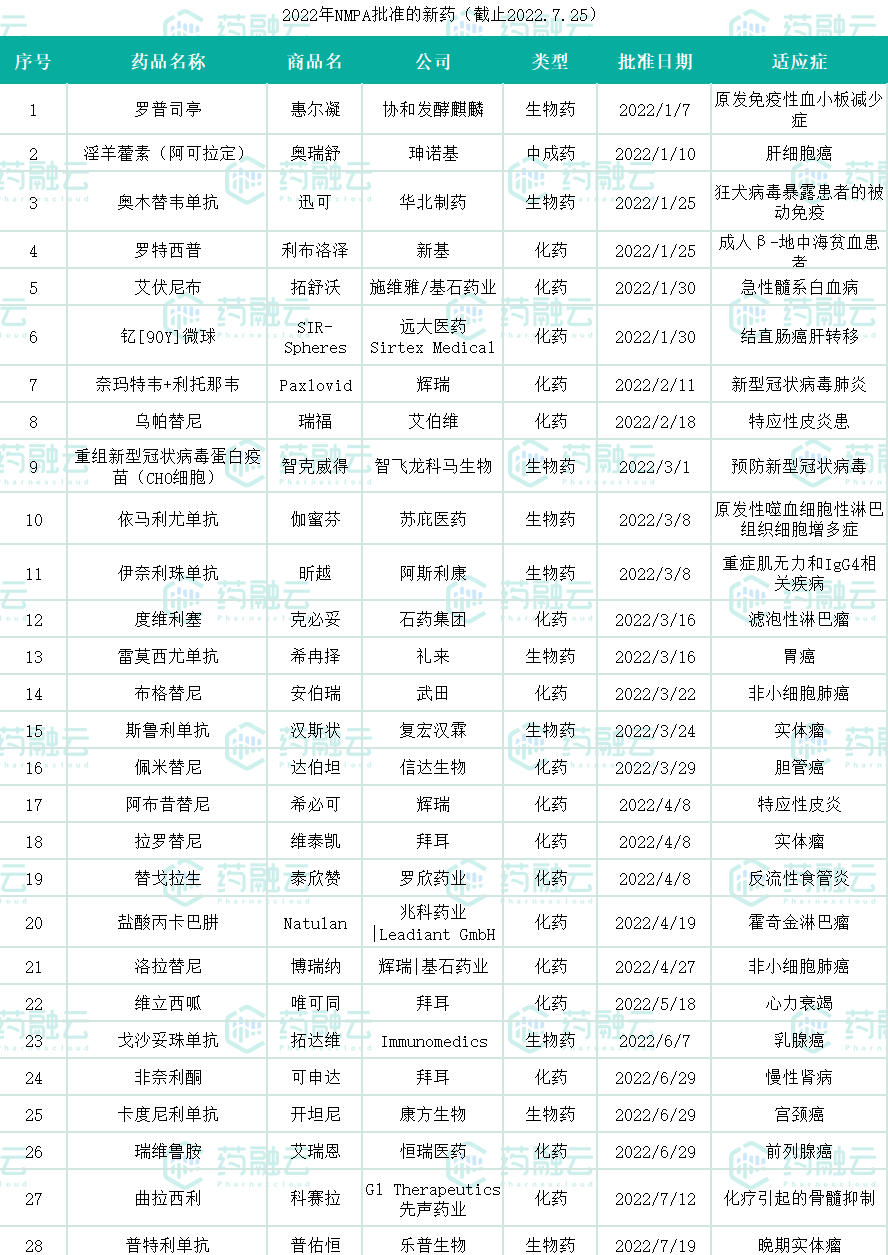
数据来源:药融云数据库综合查询
药融云公众号后台(gh_d20f87bd52d9)回复关键词“NMPA”,下载表格文件。
- 01.罗普司亭
2022年1月7日,由协和发酵麒麟申报的注射用罗普司亭已获得中国NMPA批准上市。罗普司亭是安进原研,协和发酵麒麟拥有该产品在大中华区、韩国、新加坡等地区的开发权。此前,罗普司亭已在全球数十个国家和地区获批上市,用于免疫性血小板减少症(ITP)。

- 02.淫羊藿素软胶囊
2022年1月10日,国家药品监督管理局发布通过优先审评审批程序附条件批准1.2类创新药淫羊藿素软胶囊上市。该品种上市为肝细胞癌患者提供了新的治疗选择。药品上市许可持有人为北京珅诺基医药科技有限公司。
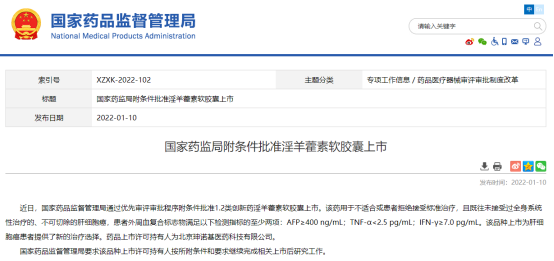
淫羊藿素是从天然药用植物淫羊藿中提取、分离、纯化而来的单体化合物(含量>98%),其研发历时十余年,先后获得了国家科技部“十一五”、“十二五”和“十三五”“重大新药创制”科技重大专项等多项支持。在一项由中国医学科学院肿瘤医院、中国工程院孙燕院士和南京金陵医院秦叔逵教授牵头领导,全国28家研究中心共同参与完成的多中心、随机、双盲、双模拟Ⅲ期研究中,淫羊藿素软胶囊用于不可切除的晚期肝细胞癌一线治疗,在预后更差的富集人群中相较于华蟾素对照组显示出持续显著生存获益和更优的安全性及生活质量。在最新更新的《CSCO肝癌诊疗指南(2022版)》正式将淫羊藿素软胶囊纳入晚期肝癌一线治疗推荐药物目录(Ⅰ级专家推荐)。国家卫健委发布的《原发性肝癌诊疗指南(2022版)》也将淫羊藿素软胶囊作为推荐方案。
- 03.奥木替韦单抗
2022年1月25日,中国国家药监局(NMPA)官网最新公示显示,华北制药1类新药奥木替韦单抗注射液(ormutivimab injection)已在中国获批,用于成人狂犬病毒暴露者的被动免疫。
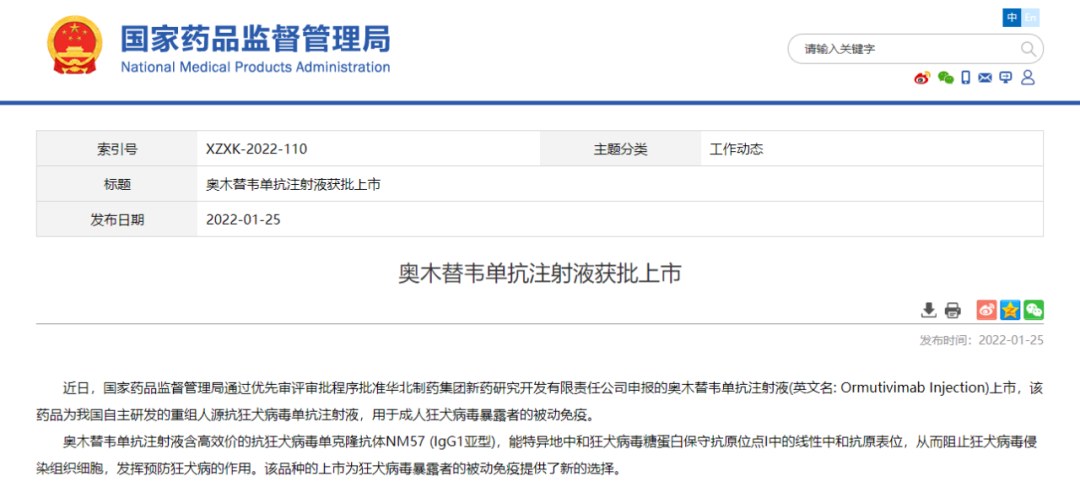
奥木替韦单抗注射液含高效价的抗狂犬病毒单克隆抗体 NM57 (IgG1 亚型),能特异地中和狂犬病毒糖蛋白保守抗原位点 I 中的线性中和抗原表位,从而阻止狂犬病毒侵染组织细胞,发挥预防狂犬病的作用。该品种的上市为狂犬病毒暴露者的被动免疫提供了新的选择。
- 04.罗特西普
2022年1月25日,百时美施贵宝制药子公司新基医药「注射用罗特西普」获批进口,用于需要定期输注红细胞(RBC)的成人 β-地中海贫血患者。该药未在中国境内进行临床试验而直接利用境外临床数据报上市,刷新了进口新药在中国上市的速度。

罗特西普的上市申请是基于一项名为 BELIEVE 的全球 III 期临床研究数据。BELEVE 是一项随机、双盲、安慰剂对照、多中心的 III 期临床研究,比较了 Luspatercept + 最佳支持治疗(BSC)与安慰剂 + BSC 对需要定期输注红细胞的成人 β 地中海贫血患者的疗效。试验共入组 336 名患者,在 15 个国家的 65 个临床试验中心展开。结果显示,经 Luspatercept 治疗后,有 21.4% 的患者的输血负担与基线相比降低超过 33%,显著优于安慰剂组(4.5%),且患者铁过载显著降低,由此可能改善患者生活质量。
- 05.艾伏尼布
2022年1月30日,国家药监局批准基石药业同类首创药物艾伏尼布片的新药上市申请。艾伏尼布片是中国首个获批的IDH1抑制剂,用于治疗携带IDH1易感突变的成人复发或难治性急性髓系白血病(R/R AML)患者。这个药物最初由Agios开发,后来Agios的肿瘤业务被施维雅收购,产品权益归施维雅所有。2018年6月,基石药业与Agios达成在大中华区开发及商业化的独家协议,并于2020年将其临床开发和商业化授权区域从大中华区扩展至新加坡。

2022年6月9日,基石药业宣布,其研发的同类首创IDH1靶向药物拓舒沃(艾伏尼布片)已在中国医学科学院血液病医院、哈尔滨血液病肿瘤研究所、苏州大学附属第一医院等15家医院开具首批处方,并正式面向全国多个省市的39家院内和院外药房供药。这标志着拓舒沃(艾伏尼布片)作为中国首个获批用于治疗IDH1易感突变的成人复发或难治性急性髓系白血病(R/R AML)的创新疗法正式开始惠及中国患者。
- 06.钇[90Y]微球
2022年1月30日,远大医药申报的钇[90Y]微球(SIR-Spheres®)在中国获批,适应症为用于经标准治疗失败的不可手术切除的结直肠癌肝转移患者的治疗。

钇[90Y]微球注射液此次的获批填补了我国结直肠癌肝转移治疗的空白,将为经标准治疗失败的不可切除的患者带来转化切除和治愈的希望。目前国内多家医院已经具备或正在准备钇[90Y]微球注射液的使用条件,包括中国人民解放军总医院、北京大学肿瘤医院等。
- 07.奈玛特韦+利托那韦
2022年2月11日,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准辉瑞公司新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(即Paxlovid)进口注册。本品为口服小分子新冠病毒治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,例如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。
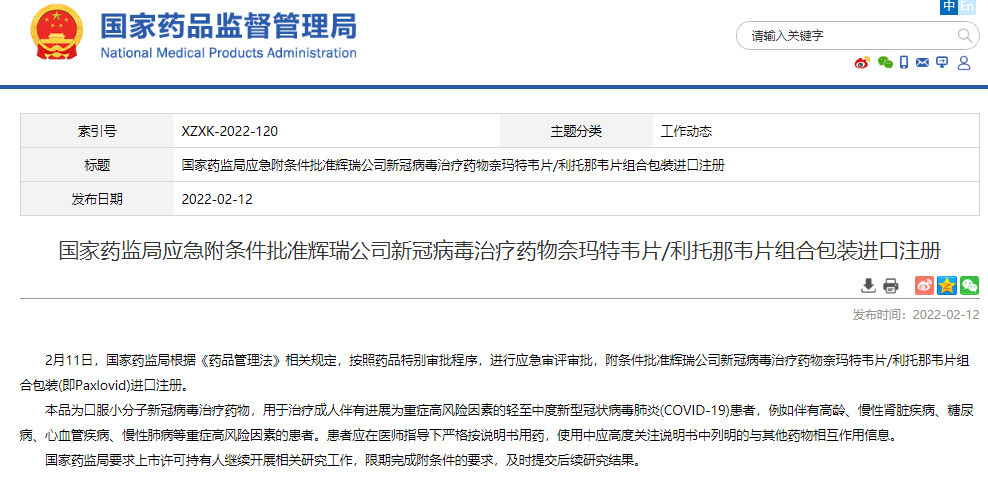
Paxlovid是辉瑞公司研发的奈玛特韦片/利托那韦片组合药。奈玛特韦是一种蛋白酶抑制剂,其作用是阻断冠状病毒复制必需的蛋白酶活性。而利托那韦则用于减缓奈玛特韦新陈代谢或分解,使其在较高浓度下在体内保持更长时间活性,从而共同影响病毒的繁殖。根据辉瑞此前公布的临床试验数据,与安慰剂组相比,在症状发作后3天和5天内接受Paxlovid治疗的患者中,新冠患者的住院或死亡率分别降低了89%和88%,病毒载量降低了10倍。28天研究总体人群中,接受该药物的患者没有报告死亡,而接受安慰剂的患者有10 例(1.6%)死亡。
- 08.乌帕替尼
2022年2月18日,艾伯维的乌帕替尼缓释片上市申请获中国NMPA批准,用于适合系统性治疗的成人和12岁及12岁以上青少年中重度特应性皮炎患者。

乌帕替尼(商品名:Rinvoq )是由艾伯维研发的一款每日口服1次的JAK1抑制剂,最早于2019年8月在美国获批用于治疗类风湿关节炎,随后在欧洲和日本获批。值得一提的是,2021年8月,乌帕替尼在欧洲扩展特应性皮炎新适应症,成为首个在欧盟获批治疗特应性皮炎的JAK抑制剂。目前,乌帕替尼在全球已获批的适应症有特应性皮炎、银屑病关节炎、强直性脊柱炎和类风湿性关节炎。
- 09.重组新型冠状病毒蛋白疫苗(CHO细胞)
2022年3月1日,在经过一年的紧急使用后,智飞生物旗下重组新型冠状病毒蛋白疫苗(CHO细胞)获得中国NMPA附条件上市。
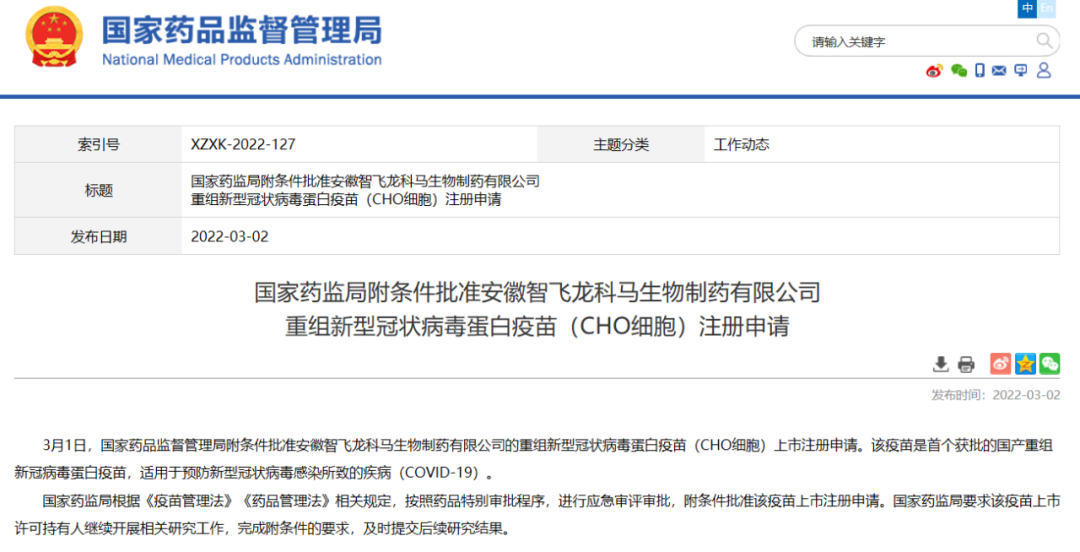
2022年2月19日,国务院联防联控机制举行新闻发布会,国家卫生健康委疾控局副局长吴良有表示,经国务院联防联控机制批准,国家卫生健康委已开始部署序贯加强免疫接种。其中,智飞龙科马重组新冠蛋白疫苗已获批作为新冠灭活疫苗的序贯(异源)加强针。
- 10.依马利尤单抗
2022年3月8日,苏庇医药申请的依马利尤单抗注射液的新药上市申请已获得批准。根据中国国家药监局药品审评中心(CDE)优先审评公示,该产品将用于:难治性、复发性或进展性疾病或对常规HLH疗法不耐受的原发性噬血细胞性淋巴组织细胞增多症(HLH)成人和儿童患者的治疗。
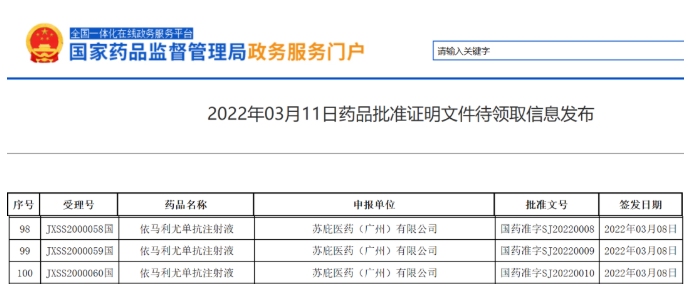
依马利尤单抗(emapalumab)最初由Novimmune SA公司开发,Swedish Orphan Biovitrum AB(苏庇医药)于2018年通过独家许可协议获得了依马利尤单抗的全球权益。这是一款与干扰素γ(IFNγ)结合的单克隆抗体,能够中和IFNγ的作用。IFNγ是诱导细胞凋亡的关键细胞因子,IFNγ的大规模过度表达被认为是导致免疫系统过分激活的主要原因,这最终会导致器官衰竭。
- 11.伊奈利珠单抗
2022年3月8日,翰森药业的 CD19 单抗伊奈利珠单抗注射液(Inebilizumab)获批上市,用于视神经脊髓炎谱系障碍(NMOSD)。这是翰森制药首款获批上市的生物药。
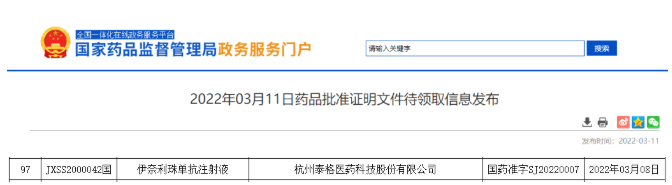
2019 年 5 月,翰森制药以超过 2.2 亿美元的首付款+里程碑付款从 Viela Bio 公司获得了该药在中国的开发和商业化权益。NMOSD 是一种罕见、严重、复发性的神经炎症性自身免疫疾病,以视神经和脊髓的炎性病变为特征。2018 年 5 月被纳入国家 121 种罕见病目录。NMOSD 全球总患病率为 1.82/10 万,多见于亚洲患者。伊奈利珠单抗在国内成功上市,给该疾病患者带来了为数不多的治疗选择。
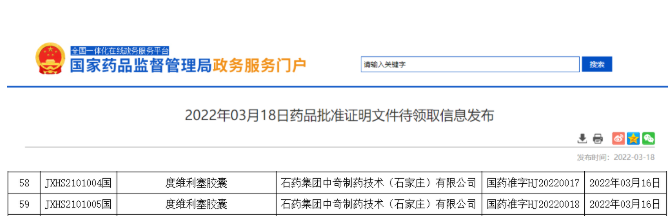
- 12.度维利塞
2022年3月16日,石药集团引进的克必妥(度维利塞胶囊)获批上市,适应症为:适用于治疗既往至少经过两次系统治疗的复发或难治性滤泡性淋巴瘤(FL)。度维利塞(Copiktra)是Verastem Oncology开发的一款创新PI3K-δ和PI3K-γ口服双重抑制剂。其对PI3K-δ的抑制导致恶性肿瘤细胞凋亡,而对PI3K-γ的抑制则减少了肿瘤微环境中支持细胞的分化和转移。2018年9月,石药集团与Verastem公司签订协议,获得度维利塞在中国的独家权益。
目前,PI3K是新药研发的热门靶点之一,该靶点信号通路中关键节点的不同类型抑制剂正处于不同的临床阶段,以治疗各类肿瘤。
- 13.雷莫西尤单抗
2022年3月16日,礼来的靶向VEGFR2单抗雷莫西尤单抗(Ramucirumab)获NMPA批准上市,适应症为晚期胃或胃食管结合部腺癌二线治疗。雷莫西尤单抗 (Ramucirumab) 是一款人血管内皮生长因子受体2(VEGFR2)拮抗剂,它能够特异性地与VEGFR2结合,阻断这一受体与VEGF-A、C、D的结合,从而抑制血管增生,使肿瘤无法进一步生长或蔓延。

胃癌是我国发病数量第3高的恶性肿瘤,2020年我国新发胃癌病例数约为48万,约占全球新发胃癌病例的44%。2020年我国因胃癌导致死亡人数达37万,占全球胃癌死亡数量近一半。雷莫西尤单抗在国内获批给广大胃癌患者带来了新的希望。
- 14.布格替尼
2022年03月22日,武田制药 5.1 类进口新药布格替尼(Brigatinib) 获批上市,适应症为间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性的非小细胞肺癌(NSCLC)患者的治疗。布格替尼为新型第二代ALK靶向药,能够显著降低ALK阳性晚期非小细胞肺癌患者的疾病进展或死亡风险,延长无进展生存期(PFS),实现总生存获益。
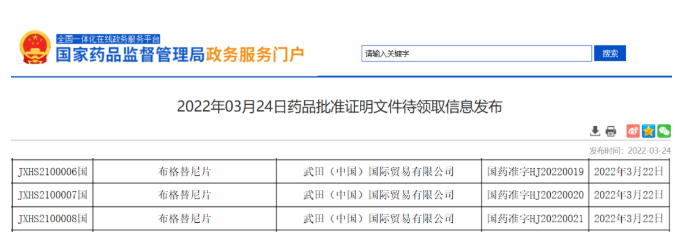
目前该药已在包含美国、日本等多个国家上市,在美国NCCN发布的非小细胞肺癌(NSCLC)最新指南中,布格替尼被推荐为 ALK阳性晚期NSCLC一线治疗首选用药
- 15.斯鲁利单抗
2022年3月24日,国家药监局官网发布,复宏汉霖的 PD-1 单抗斯鲁利单抗获批,获批适应症:用于经过标准治疗失败的、不可切除或转移性高度微卫星不稳定型(Microsatellite Instability-High,MSI-H)实体瘤。
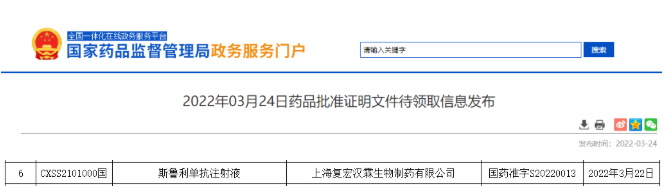
斯鲁利单抗为复宏汉霖自主开发的创新型抗 PD-1 单抗,这是国内第九款获批上市的PD-1单抗(7款国产、2款进口),同时也是首款国产“泛癌种”PD-1。据了解,斯鲁利单抗注射液(商品名:汉斯状)在已经上架销售的部分药店公开零售价(不考虑优惠赠药等福利):100mg(10ml) / 瓶:5588元(含税),价格比较亲民,不过也一定程度增加了国内PD-1/L1市场的内卷程度。
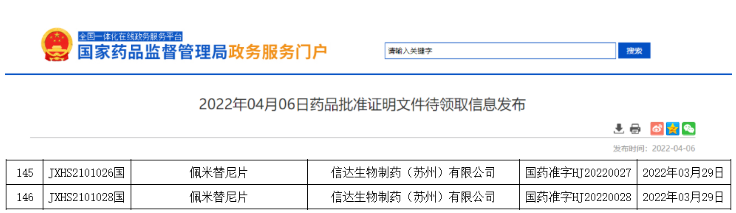
- 16.佩米替尼
2022年3月 29日,信达生物的「佩米替尼片」获批上市,用于既往至少接受过一种系统性治疗、且经检测确认存在有 FGFR2 融合或重排的晚期/转移性或不可手术切除的胆管癌成人患者。这是首款在中国获批上市的胆管癌靶向治疗药物,填补了这一领域的治疗空白。两年前的2020年4月17日,佩米替尼曾经作为首款胆管癌靶向药物获得了FDA的加速批准。
信达生物在2018 年 12 月与 Incyte 达成战略合作,获得了该公司包括佩米替尼(Pemigatinib)在内的 3 款药物在中国内地及港澳台地区的临床开发和商业化权益。合作中的另外两款分别为 itacitinib(JAK1 抑制剂)和 parsaclisib(PI3Kδ 抑制剂)。
- 17.阿布昔替尼
2022年4月8日,NMPA通过优先审评审批程序批准辉瑞公司申报的1类创新药阿布昔替尼片(商品名:希必可/CIBINQO)上市。该药适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人患者。
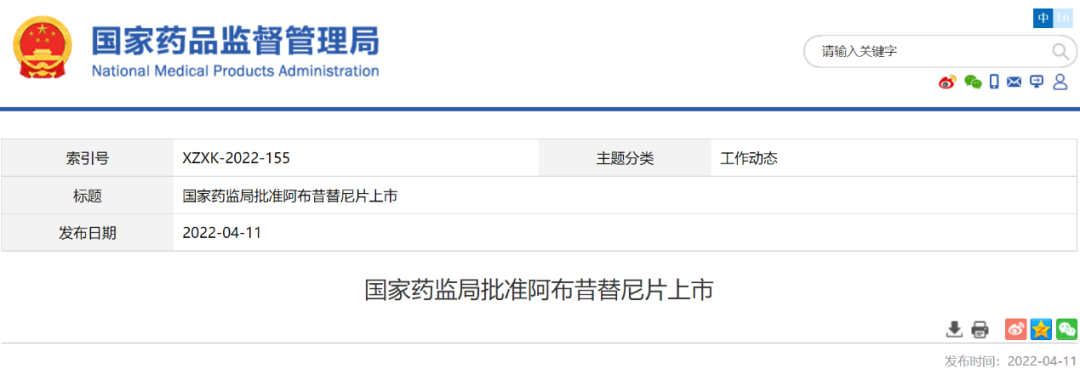
阿布昔替尼是Janus激酶(JAK)1抑制剂。JAK是一种细胞内酶,介导细胞膜上的细胞因子或生长因子受体相互作用而产生的信号传导,从而影响细胞造血功能和免疫细胞功能。阿布昔替尼通过阻断三磷酸腺苷(ATP)结合位点可逆性和选择性地抑制JAK1。该药品的上市为特应性皮炎患者提供了新的治疗选择。
- 18.拉罗替尼
2022年4月8日,拜耳(Bayer)公司larotrectinib(硫酸拉罗替尼胶囊)的上市申请已获得NMPA批准,用于治疗携带NTRK融合基因的实体瘤成人和儿童患者。
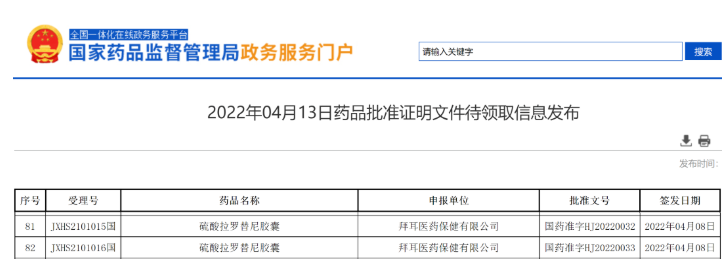
拉罗替尼是一款专门针对NTRK(神经营养因子受体酪氨酸激酶)基因融合突变的癌症患者的口服TRK抑制剂。该药于2018年首次获批上市,也是FDA首个批准的TRK抑制剂,其最受关注的特点是作为“不限癌种”的疗法,广泛用于多种癌症的治疗并获得75%的总缓解率的良好数据。
- 19.替戈拉生
2022年04月8日,罗欣药业研发的替戈拉生片(商品名:泰欣赞®)获得中国NMPA批准用于治疗反流性食管炎(RE)。

替戈拉生(Tegoprazan)片是钾离子竞争性酸阻滞剂(P-CAB),通过与钾离子竞争作用,可逆性与H+/K+-ATP酶结合,且能够同时抑制其静息与激活两种状态,从而持久抑制胃酸分泌。具有30分钟快速起效、强效持久抑酸、服用方便等特点,为治疗反流性食管炎、改善患者的生活质量带来全新的用药选择。
- 20.盐酸丙卡巴肼
2022年4月19日,李氏大药厂子公司兆科药业申报的抗肿瘤新药盐酸丙卡巴肼胶囊在国内获批上市,用于晚期霍奇金淋巴瘤治疗。
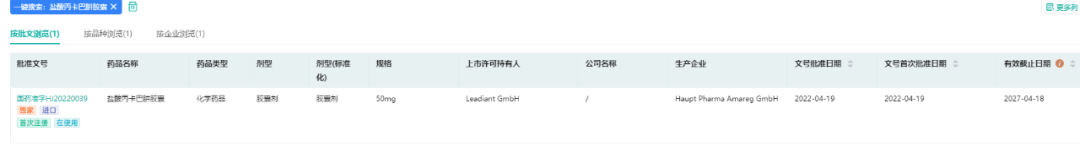
盐酸丙卡巴肼胶囊是由罗氏研发的一种烷化剂药物,也是一种周期非特异性抗肿瘤药,在临床上适用于治疗晚期霍奇金淋巴瘤及部分脑癌。李氏大药厂通过授权合作,获得该药物在大中华地区独家商业化权益。
- 21.洛拉替尼
2022年4月27日,洛拉替尼(lorlatinib)片成功获得NMPA批准,用于治疗ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)。
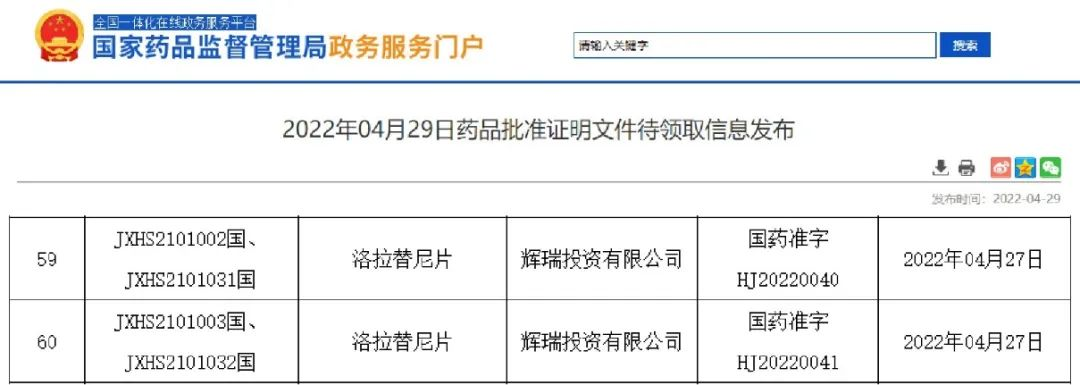
与同靶点最经典的第一代药物克唑替尼相比,洛拉替尼的疗效有全面的提升,且不仅能够用于治疗耐药患者,还能够有效清除脑转移病灶!该药已经成为了针对“钻石”靶点ALK的一颗冉冉升起的治疗新星。
- 22.维立西呱
2022年5月18日,NMPA通过优先审评审批程序批准拜耳公司申报的1类创新药维立西呱片(商品名:唯可同/Verquvo)上市。该药适用于近期心力衰竭失代偿经静脉治疗后病情稳定的射血分数降低(射血分数<45%)的症状性慢性心力衰竭成人患者,以降低发生心力衰竭住院或需要急诊静脉利尿剂治疗的风险。
维立西呱是第一种每日口服一次的直接水溶性鸟苷酸环化酶(sGC)激动剂。sGC对血管和心脏的功能都很重要,然而,在心力衰竭患者体内sGC不能被充分激活,从而导致心肌和血管功能异常。维立西呱通过激活sGC,恢复了关键信号途径(NO-sGC-cGMP)的功能。2014年5月,拜耳与默沙东达成研发协议,共同开发和推广维立西呱。
- 23.戈沙妥珠单抗
2022年6月7日,云顶新耀引进的注射用戈沙妥珠单抗的上市申请已经获得NMPA批准。依据此前公开信息,此次获批的适应症为:治疗接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。

这是全球首个且唯一获批的靶向Trop-2的ADC药物(抗体偶联药物)。该药的靶点为Trop-2受体,这是一种在许多类型肿瘤(包括超过90%的乳腺癌和膀胱癌)中均过度表达的细胞表面抗原。拓达维专门有一个可与有效载荷拓扑异构酶I抑制剂SN-38相连的可水解连接子,这种独特的设计保证了在Trop-2表达细胞和邻近微环境中的有效活性。
- 24.非奈利酮
2022年6月29日,国家药品监督管理局批准拜耳公司申报的1类创新药非奈利酮片(商品名:可申达/Kerendia)上市。该药适用于与2型糖尿病相关的慢性肾脏病成人患者(肾小球滤过率估计值[eGFR]25 至<75 mL/min/1.73 m2,伴白蛋白尿),可降低eGFR持续下降、终末期肾病的风险。
非奈利酮是一种非甾体类、选择性盐皮质激素受体(MR)拮抗剂。MR在肾脏、心脏和血管中均有表达,非奈利酮可减轻MR过度激活介导的炎症和纤维化。该药品的上市为2型糖尿病相关的慢性肾脏病成人患者提供了新的治疗选择。
- 25.卡度尼利单抗
2022年6 月 29 日,NMPA 发布公告,康方生物自主研发的 PD-1/CTLA-4 双特异性抗体卡度尼利单抗注射液获批上市,用于既往接受过含铂化疗治疗失败的复发或转移性宫颈癌患者。
卡度尼利单抗是首个获批上市的国产双抗(基于单克隆抗体发展而来的双特异性抗体),也是全球首款PD-1/CTLA-4双抗。该药可阻断PD-1和CTLA-4与其配体PD-L1/PD-L2和B7.1/B7.2的相互作用,从而阻断PD-1和CTLA-4信号通路的免疫抑制反应,促进肿瘤特异性的T细胞免疫活化,进而发挥抗肿瘤作用。双抗作为“第二代”的免疫治疗药物,不仅能使免疫治疗的疗效达到“1+1”的效果,还能够尽可能地减少不良反应的发生,让治疗更加安全、患者更容易承受,卡度尼利单抗市场发展未来可期。
- 26.瑞维鲁胺
2022年6月29日,根据国家药监局(NMPA)官网最新公示,恒瑞医药的产品瑞维鲁胺片获批上市。
国家药品监督管理局通过优先审评审批程序附条件批准江苏恒瑞医药股份有限公司申报的1类创新药瑞维鲁胺片(商品名:艾瑞恩)上市。该药适用于治疗高瘤负荷的转移性激素敏感性前列腺癌(mHSPC)患者。瑞维鲁胺是一种雄激素受体(AR)抑制剂,可竞争性抑制雄激素与AR结合,从而抑制AR核移位及DNA结合,降低AR介导的基因转录。该品种上市为前列腺癌患者提供了新的治疗选择。
- 27.曲拉西利
2022年7月12日,注射用盐酸曲拉西利(科塞拉)获NMPA批准上市!获批适应症为:接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌(ES-SCLC)患者中预防性使用曲拉西利,以降低化疗引起的骨髓抑制的发生率。这是全球首款用于全面预防骨髓抑制的CDK4/6抑制剂!该药物已于2021年2月获得FDA批准,并进入同年的NCCN指南推荐,商品名Cosela。

先声药业与G1 Therapeutics公司合作引进的创新药曲拉西利,以一种全新机制减少骨髓抑制的发生:它通过抑制CDK4/6的活性,可以将骨髓中的造血干/祖细胞等暂时地阻滞在细胞周期的G1期,让细胞暂时停止分裂,从而“躲过”化疗药物的杀伤。
- 28.普特利单抗
2022年7月22日,NMPA官网显示,乐普药业的PD-1单抗普特利单抗获得批准上市,适用于不可切除或转移性的高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)的晚期实体瘤患者。

普特利单抗(pucotenlimab)是通过使用人IgG4亚型针对人PD-1的人源化单抗。它可以拮抗PD-1信号,通过阻断PD-1与其配体PD-L1及PD-L2的结合来恢复免疫细胞杀死癌细胞的能力。同时,普特利单抗采用抗体工程技术,于Fc区引入突变,提高FcRn的结合亲和力,从而大幅延长其半衰期,提高患者的临床疗效及药物依从性。
—END—


















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论