
6月30日,NMPA发布了一大波批准件,其中有两款复杂注射剂,棕榈酸帕利哌酮注射液(Ⅱ)和布比卡因脂质体注射液,这两款注射液都是中美双报。
一款FDA早一步获批上市,一款FDA早一步获批适应症。
两款都压着国谈截止日获批,目标很明确。
一、先一步在FDA获批的改良药
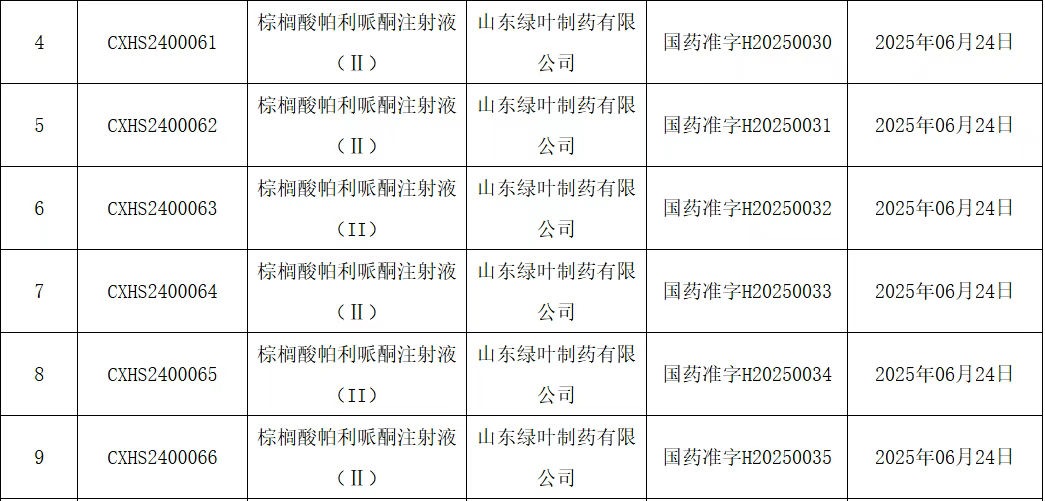
棕榈酸帕利哌酮注射液(Ⅱ)(又名棕榈酸帕利哌酮缓释混悬注射液),绿叶制药的一款改良型制剂获批。
2024年7月28日,绿叶制药集团宣布,其自主研发的用于精神分裂症成人患者的治疗的长效针剂ERZOFRI®(棕榈酸帕利哌酮缓释混悬注射液)已根据联邦食品、药品和化妆品法案第505(b)(2)条款获得FDA的上市批准。
在FDA获批一年之后,棕榈酸帕利哌酮注射液(Ⅱ)才在国内获批。
绿叶制药有一同成分仿制药,棕榈酸帕利哌酮注射液在2024年6月12日过评,原研强生2011年在国内获批上市,2023年齐鲁首仿过评,目前也就强生、齐鲁、绿叶三家企业拥有文号,该品种是医保产品但非国谈产品。
整体市场在3.6亿元左右,强生占去96%,齐鲁得了剩下的4%,绿叶暂时无数据。
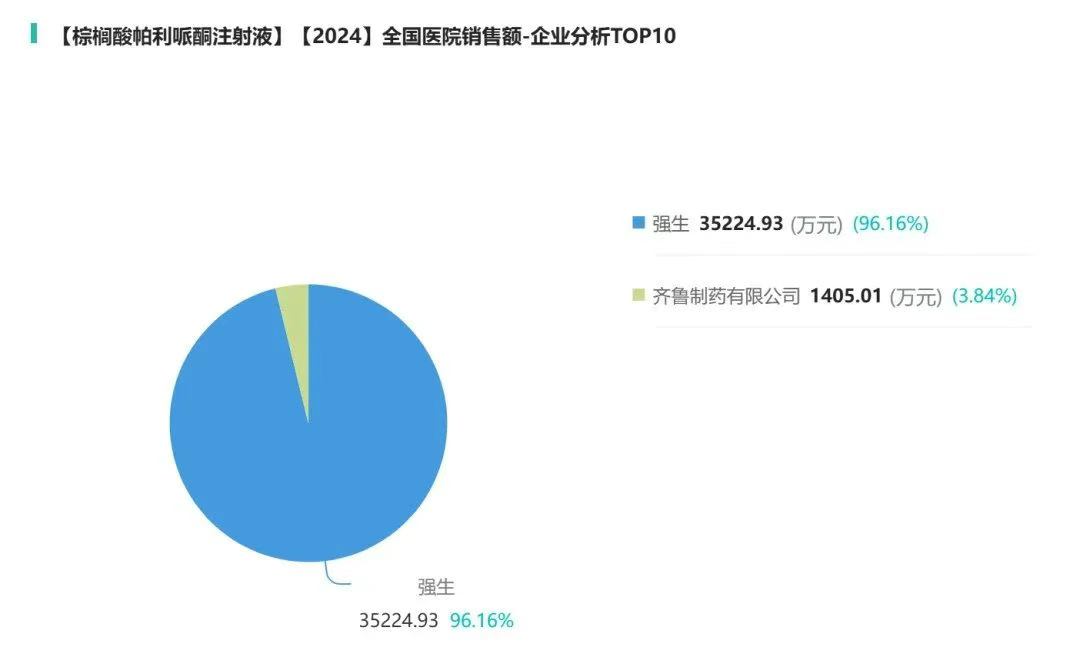
图源:摩熵医药
棕榈酸帕利哌酮注射液在国内前有强生后又齐鲁,绿叶占不到竞争优势,绿叶做了出海的决定,改良制剂ERZOFRI®先一步在FDA获批上市。
两款注射液均为一月一次,长效给药,区别在于ERZOFRI®可避免初始给药需不同剂量且要分隔7天的要求,ERZOFRI®在美国的关键临床试验显示:该产品通过简化的起始用药方案,有望使患者获得更好的依从性并减少用药管理上的挑战。
2025年1月17日,绿叶制药宣布正式开启ERZOFRI®在美商业化,首批货物价值数千万美金。
此次ERZOFRI®国内获批,就看这一简化起始用药方案能否在国内占竞争优势,以及能否凭这一优势入国谈目录了。
二、先一步在FDA获批的适应症
江苏恒瑞的布比卡因脂质体注射液同样在6月30日获得批准文件。

CYHS2401989是一致性评价受理号,但批准字号未变,该品种恒瑞早就在2022年首仿获批,再批一次是什么?
该受理号是增加适应症,恒瑞医药6月30日发布公告,布比卡因脂质体注射液新增了两个适应症:
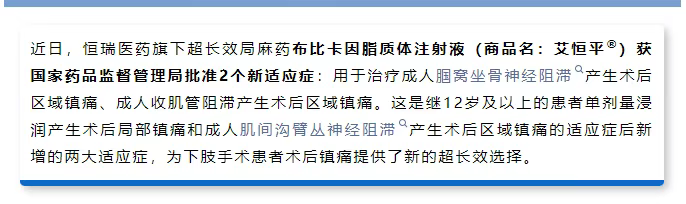
图源:恒瑞官方公众号
仿制药增加适应症要走上市申请了?
是的,布比卡因脂质体注射液原研未在国内上市,目前仅有江苏恒瑞和湖南科伦过评并上市。在2023年,FDA对布比卡因脂质体注射液扩展了两项适应症,批准其用于收肌管阻滞和腘窝坐骨神经阻滞,国内在此之前过评的江苏恒瑞和湖南科伦均无此适应症。
恒瑞的艾恒平®于2024年7月1日在美国成功获批上市,是该品种全球范围内获批上市的首仿药,美国上市时艾恒平®就有那两项新增的适应症。
境外已批准境内未批准的适应症要在国内获批,需要进行上市许可申请,这也就是为什么申请文号是CYHS2401989。
图源:CDE官网
布比卡因脂质体注射液在2023年被新增入国谈目录,纳入国谈后,市场增涨飞快,2024年就达到了五千万销售额,且恒瑞独家。
布比卡因脂质体注射液国谈协议期截止到2025年底,今年需要再谈续约事宜,恒瑞压着国谈截止最后一天获批新适应症,对布比卡因脂质体注射液续约国谈存在优势。
国谈续约一般都得降价,且今年恒瑞新增了科伦一家竞争对手,原本面临着竞价。新增两个适应症之后,谈判价格必定会有优势。
想要解锁更多药企信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!




















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论