
创新时代的车轮滚滚向前,齐鲁制药持续加大研发投入,积极创新弯道超车。据药融云统计,齐鲁制药今年在千亿肿瘤免疫市场持续布局,目前已有1款1类新药申报上市——依鲁奥克片,预计用于治疗非小细胞肺癌;9款1类新药获批临床(默示许可),主要瞄准的是抗肿瘤药物研发,其中QL1706注射液和QL1604进展最快,最高已至临床III期阶段,后者近日又迎来研发新动态。
抗肿瘤药物研发新进展,齐鲁制药PD-1单抗II期临床结果公布
12月4日,齐鲁制药宣布,在2022年欧洲肿瘤内科学会亚洲大会(ESMO ASIA)上,该公司以口头报告形式公布了PD-1单抗QL1604联合化疗一线治疗复发或转移性宫颈癌患者的2期临床研究结果。数据显示,患者的客观缓解率为58.7%,疾病控制率为84.8%。
QL1604是一种与PD-1结合的高选择性人源化单克隆抗体。本次报告的是一项QL1604联合化疗治疗R/M宫颈癌患者的II期、单臂、开放研究(NCT04864782)。入组的患者接受QL1604 200mg联合化疗(紫杉醇和顺铂/卡铂)治疗,每3周一次(Q3W),最多6个周期,随后接受QL1604 200mg Q3W维持治疗,直至疾病进展或其他停药事件。
QL1604基本信息(微信搜索"药融云小程序"进行相关更多数据查询)

截图来源:药融云全球药物研发数据库
数据截止时,中国12个研究中心共纳入46例R/M宫颈癌初治患者。其中,20例(43.5%)患者既往接受过手术治疗,40例(87%)患者既往接受过放疗。39例(84.8%)为复发性患者,7例(15.2%)为IV期患者。
据药融云数据库,QL1604注射液目前已针对肝癌、宫颈癌、胃或胃食管癌开展临床试验,最高已至临床III期阶段。
千亿肿瘤免疫市场,齐鲁制药领衔本土药企
据药融云统计,2021年抗肿瘤药与免疫机能调节药院内市场超1300亿元,其中,齐鲁制药凭借贝伐珠单抗注射液、聚乙二醇化重组人粒细胞刺激因子注射液等畅销品种,斩获超90亿元的销售额,名列千亿肿瘤免疫市场的生产企业TOP3,仅次于罗氏与阿斯利康,为国内药企榜首。2022年,齐鲁制药实力不减,竞争力依旧强劲。
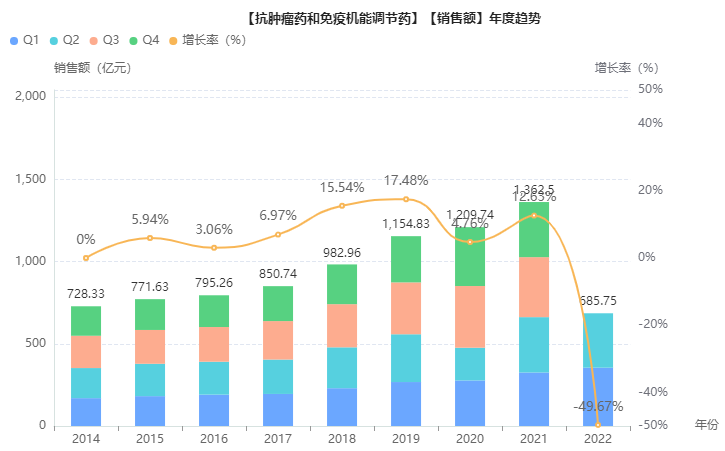
截图来源:药融云全国医院销售数据库
创新转型,猛攻肿瘤免疫市场,主要瞄准抗肿瘤药物研发
和在肿瘤免疫市场院内的优势相比,齐鲁制药的创新药商业化尚待观望,目前暂无1类新药获批上市。不过,已有1款1类新药申报上市——依鲁奥克片(受理号:CXHS2101032、CXHS2101031)。这是齐鲁制药自主研发的新型ALK/ROS1抑制剂,目前仍有多项临床试验正在进行中。
11月11日,CDE官网显示,齐鲁制药的1类生物药注射用QLF32101获批临床(默示许可),用于治疗血液系统恶性肿瘤,这是该品种首次获批临床,也是齐鲁制药今年第9款获批临床的1类新药(齐鲁制药再迎1类新药获批临床,今年累计9款猛攻千亿肿瘤免疫市场)。

截图来源:CDE官网
至此,齐鲁制药今年在肿瘤免疫市场已有9款1类新药获批临床(默示许可),抗肿瘤药物研发为主要重点,其中QL1706注射液、QL1604最高已至临床III期阶段。除注射用QLS21908用于自身免疫性疾病外,其余均用于肿瘤领域,涉及肝癌、宫颈癌、肺癌、直肠癌等多个癌种。
齐鲁制药今年在肿瘤免疫市场获批临床的1类新药
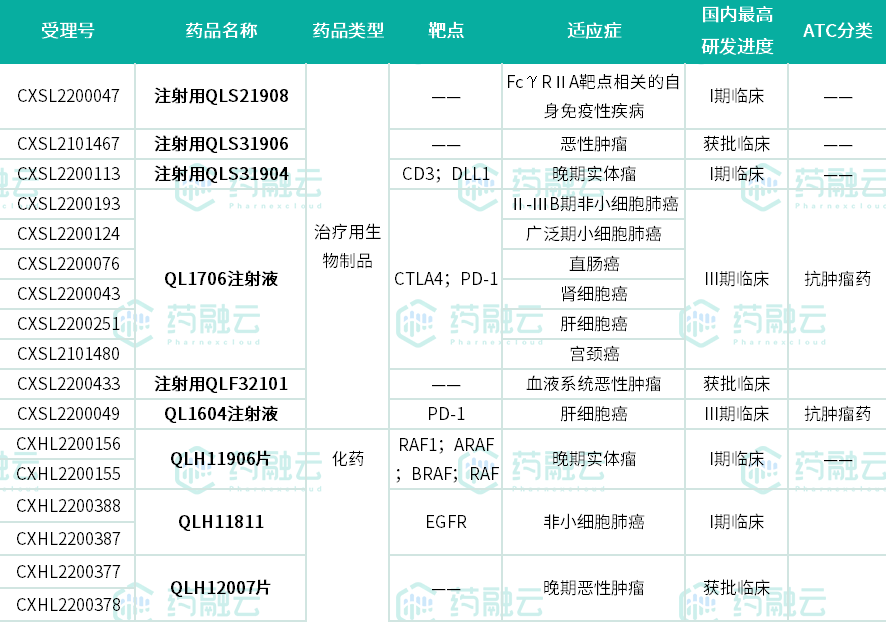
数据来源:药融云中国药品审评数据库
参考来源:
[1] CDE官网
[3] 药融云数据库
[2] 齐鲁制药官方信息
想要解锁更多药企药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企产品管线布局情况、药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

—END—


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论