注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及)。因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。
Vedolizumab
2018年11月,武田制药Vedolizumab被我国CDE列为第一批临床急需境外新药。
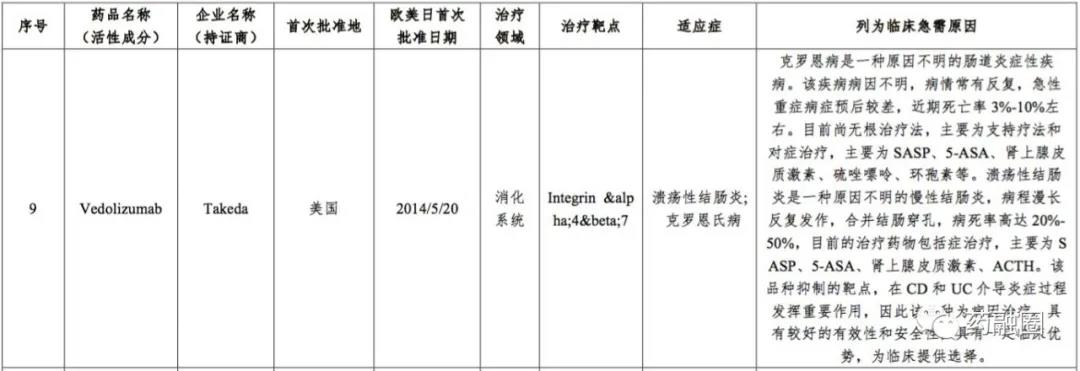
2019年6月,CDE受理了Vedolizumab新药上市申请(NDA/BLA),适应症为对传统治疗或肿瘤坏死因子α(TNFα)抑制剂应答不充分、失应答或不耐受的中重度活动性溃疡性结肠炎(UC)和克罗恩病(CD)成人患者。上市申请受理号JXSS1900032、JXSS1900033。

(来源:药融云数据库)
2020年3月,安吉优®(维得利珠单抗)在中国正式获得NMPA批准上市。2020年11月,本品正式在中国上市。
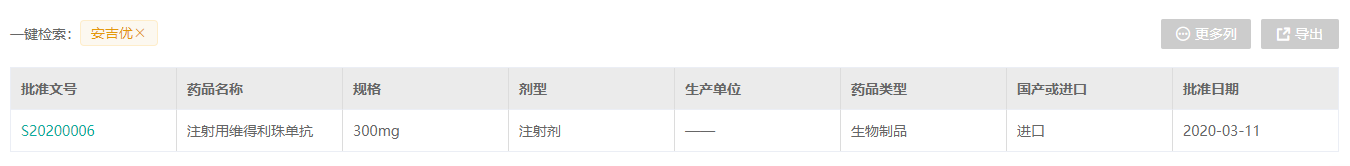
(来源:药融云数据库)
【商品名】安吉优®
【通用名】注射用维得利珠单抗
【规格】300mg/1瓶/盒
【价格】药融云数据www.pharnexcloud.com显示,售价为17365元人民币
【厂家】Takeda Pharmaceutical Company Ltd.
【适应症】溃疡性结肠炎、克罗恩病。
【储存条件】2-8℃
【用法】本品仅用于静脉输注。静脉给药前需要对其进行复溶,并进一步稀释。本品通过静脉输注给药并持续30分钟以上。请勿通过静脉推注给药。

整合素α4β7单抗的发现/发展
Vedolizumab是一种靶向整合素α4β7单抗,被批准用于治疗对传统治疗手段或抗肿瘤坏死因子治疗疗效不足或已经耐受的成人中度至重度活动性溃疡性结肠炎(UC)和克罗恩病(CD)等适应症。可与表达在记忆T淋巴细胞表面的α4β7整合素特异性结合,阻断α4β7整合素与粘膜地址素细胞粘附分子-1(MAdCAM-1)相互作用,抑制记忆T淋巴细胞迁移至肠道的炎症组织,从而减少肠道黏膜炎症。该作用具有肠道特异性。
说到Vedolizumab,不得不提及其发明人哈佛医学院传奇的Timothy Springer教授,一位成功的科研大牛,成功的生物医药创业者和投资者。Timothy Springer教授于1993年创立LeukoSite, 成功发现针对整合素 α4β7的抗体Vedolizumab (Entyvio)。
后LeukoSite公司在1999年被Millennium以6.35亿美元收购,该药物并最终由日本Takeda(武田制药)开发上市(2008年武田收购Millennium)。Vedolizumab在2020财年全球业绩约合38亿美元。

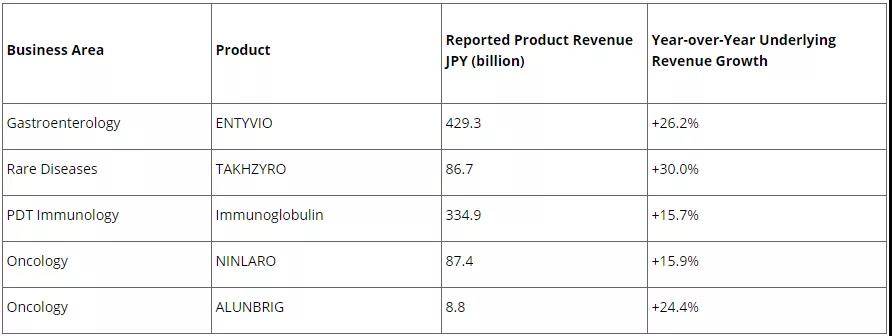
2020财年武田制药全球核心产品业绩
炎症性肠病(inflammation bowel disease,IBD)
本质是一种免疫异常所导致的肠道炎症疾病。其中最常见的两种类型即为溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(crohn disease,CD),两者最大的区别是:溃疡性结肠炎的炎症只局限于大肠,而克罗恩病的炎症可以发生于全消化道从口腔到肛门部。每年的5月19日是世界炎症性肠病日(World IBD Day)。
我国流行病学数据缺失,仅有黑龙江大庆及广东省中山市的数据。克罗恩病(CD)多发于青年期,我国发病高峰年龄为18-35岁,男性略多于女性(男女比约为1.5∶1)。

柳叶刀子刊在2020年1月发表了“过去30年间全球195个国家炎症性肠病的疾病负担分析: 1990-2017”(The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017)。该文章表示据估计,美国和欧洲有300万IBD患者,在北美、大洋洲和欧洲许多国家,IBD患病率估计超过0.3%。
除了传统治疗药物如糖皮质激素、5-氨基水杨酸、硫唑嘌呤等以外,新型治疗药物如生物制剂、小分子自身免疫疾病药物正在陆续开发中。目前,我国对于IBD治疗的生物制剂有英夫利西单抗、阿达木单抗,以及近期获批的乌司奴单抗和维得利珠单抗。目前英夫利西单抗已纳入医保,阿达木单抗仅获批用于治疗类风湿性关节炎、强直性脊柱炎和银屑病。部分IBD患者具有较大的经济压力,需要更多的企业以及政策支持,期待更多生物制剂能纳入医保名录用于治疗IBD。
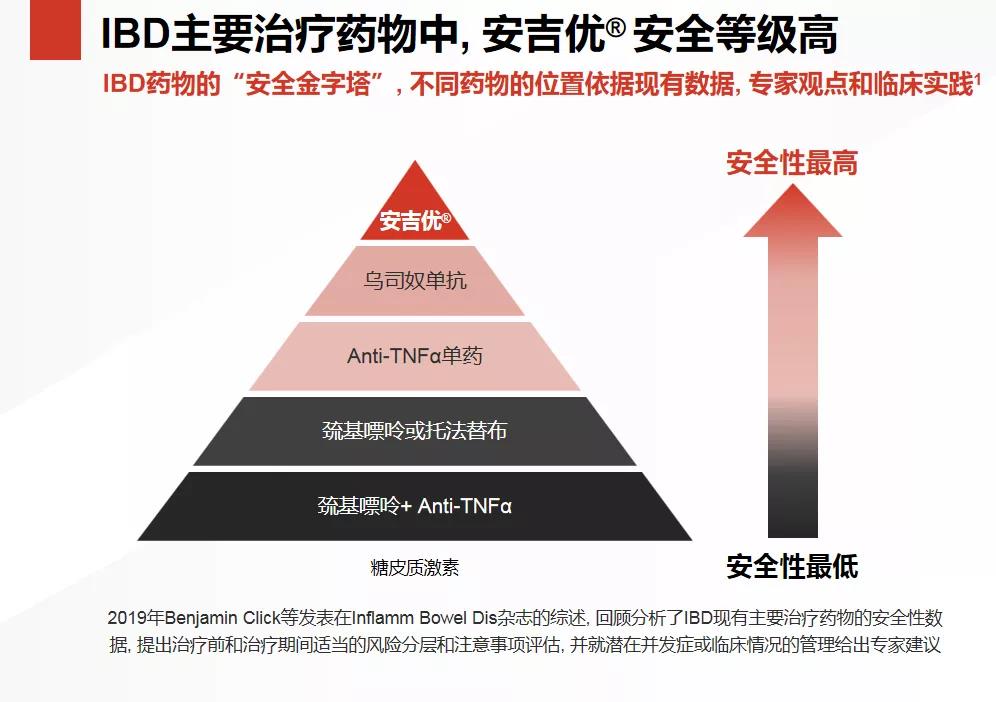
相信在未来随着医疗保健系统的改善、新药不断获批、医生诊断IBD能力的提高、患者对IBD认识的提高,IBD的诊断率和就诊率将上升,对患者是大大的利好。
参考:
NMPA/CDE;
药融云数据 www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.takeda.com/;
“蛇吞象”之后,亚洲第一的武田2020财年业绩强劲 2021指引继续攀升;
https://www.entyvio.com/;
https://www.takeda.com/investors/reports/quarterly-announcements/;
注射用维得利珠单抗(JXSS1900032-33)申请上市技术审评报告.pdf;
注射用维得利珠单抗(JXSS1900032-33)说明书.pdf;
http://www.cde.org.cn/spxxgs.do?method=show&acceptidCode=a084a79ec25bd7eabdf6abd1830d0ff2;
Mak W Y , Zhao M , Ng S C , et al. The epidemiology of inflammatory bowel disease: East meets West[J]. Journal of Gastroenterology and Hepatology, 2019.;
中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2018年,北京) [J] . 中华消化杂志,2018,38( 5 ): 292-311. DOI: 10.3760/cma.j.issn.0254-1432.2018.05.002;
钱家鸣,杨红. 中国炎症性肠病研究现状和展望[J].中华炎性肠病杂志,2017,1(1):2-4.;
Kaplan,Gilaad G. “The Global Burden of IBD: from 2015 to 2025.” Nature Reviews. Gastroenterology &Hepatology,vol. 12, no. 12, 2015, pp. 720–727.;
The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017;
https://www.sciencedirect.com/science/article/pii/S2468125319303334?via%3Dihub=;
Yamamoto-Furusho JK, Al Harbi O, Armuzzi A, et al. Incidence of suboptimal response to tumor necrosis factor antagonist therapy in inflammatory bowel disease in newly industrialised countries: The EXPLORE study.Dig Liver Dis. 2020 Aug;52(8):869-877;等等。
<END>
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论