
co-co模式的远见,不止于当下。
当114亿美元的合作金额刷屏中国医药圈时,多数目光聚焦于“BD交易纪录”的数字狂欢,却少有人读懂信达选择co-co模式的深层远见。
这不是简单的“中国超市”的又一次对外输出,而是为中国创新药出海破解“两难困境”的战略破局。
根据协议,信达生物将在签约后获得12亿美元首付款(含1亿美元溢价战略股权投资),并有机会获得最高可达十几百分比的高位销售分成。
此前,国内Biotech的全球化路径始终跳不出两个极端:要么把分子授权给海外药企,拿完首付款就彻底交出主导权,沦为被动的“资产供应商”;要么烧钱自建海外团队,每年数十亿美金砸向临床与销售,却还要承担高风险与长周期的双重压力。
而信达与武田的co-co(“全球共研+区域分商”)模式,恰好在“短期回款”与“长期能力” 之间踩准了平衡点,为信达自己铺了一条可持续的全球化路。
一、不赚“快钱”,赚“未来的能力”
长期以来,中国药企出海对于“全球化”缺乏足够深刻的认知。早年有Biotech曾将一款潜力ADC授权给美国药企,因未参与临床方案调整,对方按当地患者特征修改剂量,导致后期数据不及预期,上市时间推迟两年,原本能抢占的市场被竞争对手瓜分。
这样的教训,在行业内并非孤例。不少企业把分子授权给跨国药企后,拿到首付款便止步不前,从临床开发到上市推广,全程没有话语权。最终只能看着自己研发的“好苗子”,因不适应海外市场的临床需求或商业化节奏,在异国他乡“水土不服”,错失成为全球大药的机会。
信达的co-co模式,有望从根源上规避这种风险,将“合作”变成“能力练兵场”。
全球联合开发的约定,给了信达团队全程参与IBI363的全球开发的权利。从患者入组标准的制定,到疗效评估指标的设定,再到安全性数据的解读,每一个关键环节都会有信达团队的身影。
要知道,全球多中心试验的运营能力,是中国药企出海的核心短板。如何协调不同国家的伦理审批、如何统一数据采集标准、如何应对文化差异带来的沟通障碍,这些都需要实战积累。
依托 IBI363 全球合作开发的机会,信达可以与武田平等协商,进而通过协同直接跳过“试错阶段”,相当于在全球顶级药企的“带教”下,快速掌握全球试验的运营逻辑。
“沉浸式学习”,比单纯拿到40%的利润分成更有价值。毕竟利润是短期的,而掌握了美国市场的运营逻辑,未来其他管线出海时,信达便能省去大量试错成本,实现“一次合作,多次复用”。
二、比起“烧钱”,co-co是更可持续的“全球化杠杆”
中国创新药出海,一直绕不开“成本与回报”的博弈。百济神州通过在美国自建销售团队、独立推进全球临床,打造“自主全球化”的路径。
这种模式确实彰显了决心,但代价是每年十几亿美金的投入。
2023年,百济神州海外营收约13.5亿美元,而其海外销售与临床相关投入超16亿美元。更重要的是,这种模式对资金的依赖度极高,一旦管线研发进度不及预期,或市场反馈不佳,就可能陷入“资金链紧绷”的危机。
百济在全球融资超过100亿美元才走到今天,且有太多的天时地利人和的因素在其中,这种操作具有很强的偶然性和不可复制性。而现实是,中国Biotech中,年营收超过10亿美元的不足5家,能承担每年数十亿海外投入的更是凤毛麟角。对大多数药企而言,这样的“烧钱游戏”根本玩不起。
信达的co-co模式,恰恰用“杠杆思维”摆脱了这一困境。它不追求“全链条自建”,而是依托管线的临床价值,与武田深度绑定,将对方的资源转化为自己的“全球化工具”。
作为有着200多年历史的国际药企巨头,武田不仅搭建了覆盖全球的销售网络,更积累了成熟的市场准入策略。如何与医保机构谈判定价、如何针对不同地区医生制定推广方案、如何快速响应临床需求调整学术推广重点。这些跨国药企的“看家本领”,不是靠钱能买到的,更不是短期内能自建的。
而信达借助co-co模式,便可能通过武田的网络快速渗透市场,省去至少3~5年的市场培育期和数十亿的前期投入。这种“借力打力”的逻辑,让全球化的成本大幅降低,回报周期显著缩短,更符合大多数国内药企的实际情况。

武田业务覆盖约80个国家和地区,2023财年收入282亿美元,74%的收入来自北美和欧洲,仅美国市场就贡献了51%的收入
更具远见的是,这种模式构建了“风险共担、利益共享”的协同机制。如果信达选择独立推进IBI363的全球研发,一旦临床失败,所有投入都将付诸东流。而通过co-co模式,武田会共同承担研发成本,也会共享研发成功后的收益,这种“风险共担”机制,大幅降低了信达的单家风险。同时,双方在决策上的“平等协同”,也能避免因单一企业的判断失误导致的研发弯路。
据Pharma Intelligence统计,2019-2023年全球“共研模式”的肿瘤药研发成功率(Ⅰ期到上市)达8.3%,高于“单一企业主导”模式的5.1%。
双方最终达成共识,既保证了试验的科学性,又兼顾了不同地区的患者特征。这种“协同决策”,比单一企业的“独断专行”更能提高研发成功率,也更符合全球市场的多元化需求。
三、武田牵手信达,需求与能力的精准匹配
武田愿意开放核心资源参与co-co模式,是基于自身战略需求的必然选择。
当下,武田肿瘤板块正面临突破增长瓶颈的关键阶段——2024年其肿瘤营收占比不足15%,且缺乏年销10亿美元以上的重磅药,CEO卫博科(Christophe Weber)在多个场合强调 “必须加快突破性资产的落地”。
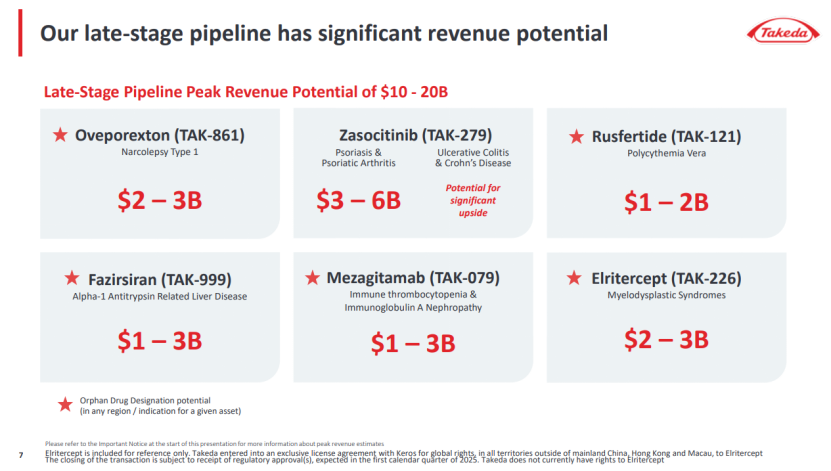
武田处于临床后期的6款重磅产品,暂无实体瘤相关产品
而信达的 IBI363 ,恰好成为武田补短板的关键资产:作为全球首创的PD-1/IL-2α双抗,它不仅能覆盖肺癌、肠癌等500亿美金规模的PD-1基本盘,还能针对现有PD-1治疗失败的耐药患者,开拓增量市场,更能打破“冷肿瘤”的治疗困境,拓宽市场边界。
IBI363若成功上市,仅在目前已探索的非小细胞肺癌、结直肠癌等适应症的覆盖下,可能就会成为武田的一款“重磅炸弹”。而且IBI363可能拥有在其他肿瘤适应症上的更大的潜力。
对武田而言,与信达的co-co合作,是其“补短板”的重要战略选择。而信达选择武田,也是看中其“开放协作”的全球化能力。此前武田曾与Arrowhead、Protagonist 等生物科技公司的合作中,共同参与临床开发、共享收益。
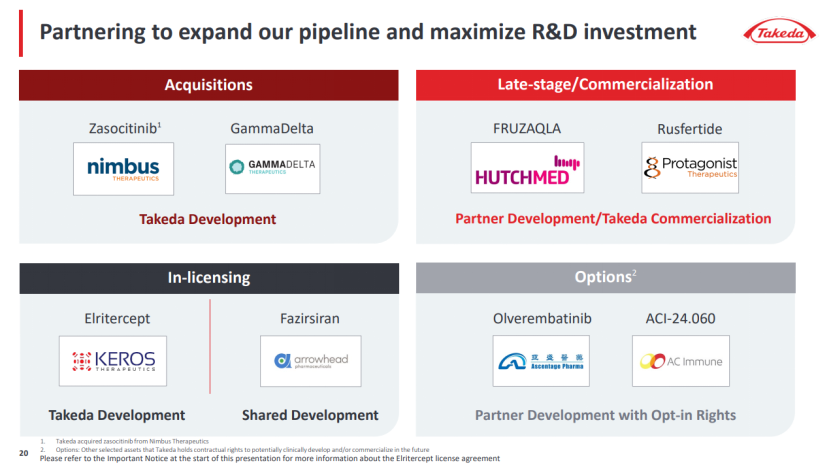
当下,中国药企出海,最缺的不是好管线,而是把管线变成“全球大药”的能力。武田在全球86个国家拥有成熟的销售网络,尤其是在消化道疾病领域,其推广团队对胃癌、胰腺癌等适应症的医生资源极为熟悉,这恰好能为 IBI343(CLDN18.2ADC)的商业化提供支撑。
IBI343针对的胃癌、胰腺癌患者中,CLDN18.2阳性比例达30%~60%,而武田此前推广的消化道肿瘤药物,曾实现“美国上市48小时内开出首张处方”的效率。
更重要的是,武田在国际注册领域的经验——其团队熟悉FDA、EMA、PMDA等不同监管机构的审批逻辑,能帮助IBI363快速通过全球各地的上市审批。这些能力,是信达短期内无法自建的,也是其他跨国药企难以替代的。
这种需求与能力的精准匹配,让co-co模式超越了单纯的商业合作,成为双方实现长期共赢的战略纽带。对武田而言,通过co-co模式锁定了能拯救肿瘤板块的重磅资产;对信达而言,借助武田的资源快速掌握了全球化运营能力,为2030年推动5款创新药进入全球多中心临床的目标提供重要支撑。
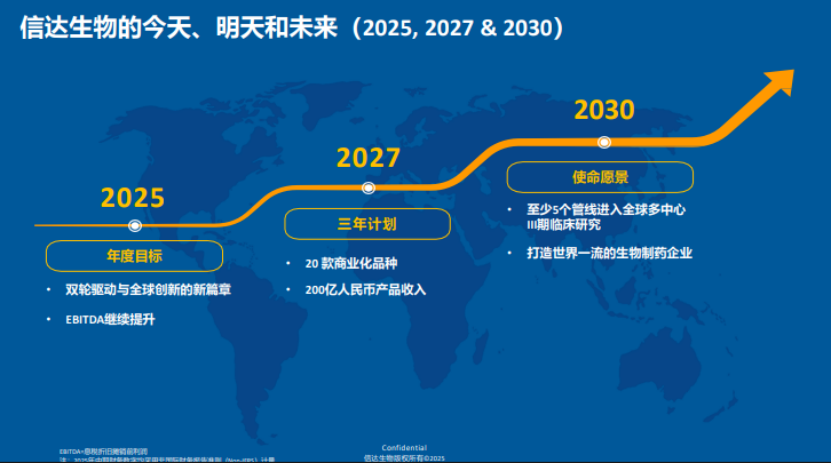
更重要的是,这种模式证明,中国创新药已经从“成本优势”转向“技术优势”,从“被动授权”转向“平等合作”,真正具备了与全球顶级药企对话的底气。
114亿美元的交易额终会被超越,但信达与武田的co-co模式,将为中国创新药全球化提供重要参考。它用实战证明,全球化不是“要么烧钱,要么低价”的两难选择,而是可以通过精准协同实现能力与收益的双赢。
当越来越多的中国药企读懂这种远见,从“卖分子”转向“建能力”,中国创新药才能真正摆脱“低端供应商”的标签,成为全球医药市场的“关键玩家”。
这,或许才是co-co模式最值得行业深思的价值。
文章来源:E药经理人
原文链接:https://mp.weixin.qq.com/s/J_Y3LnK9C4VGJ1KgwwE-Mg
扩展阅读:


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论