
10月22日,信达生物发布公告,公司与武田制药(透过其全资附属公司Takeda Pharmaceuticals International AG)达成全球战略合作,旨在加速推进信达生物新一代免疫肿瘤学(IO)及抗体偶联药物(ADC)疗法的全球开发与商业化。合作涵盖两款后期在研疗法:IBI363(PD-1/IL-2α-bias)、IBI343(CLDN18.2 ADC)及 IBI3001(EGFR/B7H3 ADC)的选择权。

根据协议,信达生物获得12亿美元首付款,其中包括通过战略股权投资获得的1亿美元。信达还有权获得合计最高达102亿美元的潜在开发与销售里程碑付款,交易总额最高可达114亿美元。此外,公司将获得各候选药物在大中华区以外市场的销售分成,其中IBI363在美国市场双方采用利润损失共担模式。
此次交易成为中国创新药企与国际制药巨头之间又一笔重磅交易,也是中国生物科技领域迄今为止规模最大的对外授权交易之一。
根据合作,信达生物与武田制药将在全球范围内共同开发新一代IO基石疗法 IBI363 (PD-1/IL-2α-bias),并在美国共同商业化,武田制药将在共同治理和协同 一致的开发计划下主导相关工作;同时,信达生物授予武田制药 IBI363 在除大中华区及美国地区的商业化权益。信达生物授予武田制药 IBI343 (CLDN18.2 ADC)在大中华区以外地区的独家权益。此外,信达生物授予武田制药 IBI3001 (EGFR/B7H3 ADC)在大中华区以外地区权益的独家选择权。
作为合作的一部分,Takeda Pharmaceuticals International AG(即认购人)与公司订立股份发行协议,据此,认购人已同意透过认购认购股份于公司进行投资,而公司同意向认购人配发及发行认购股份。认购股份将以现金方式按每股认购股份112.56港元的价格配发及发行予认购人,总港元代价相当于1亿美元(即约7.78亿港元)。认购股份将根据一般授权配发及发行。
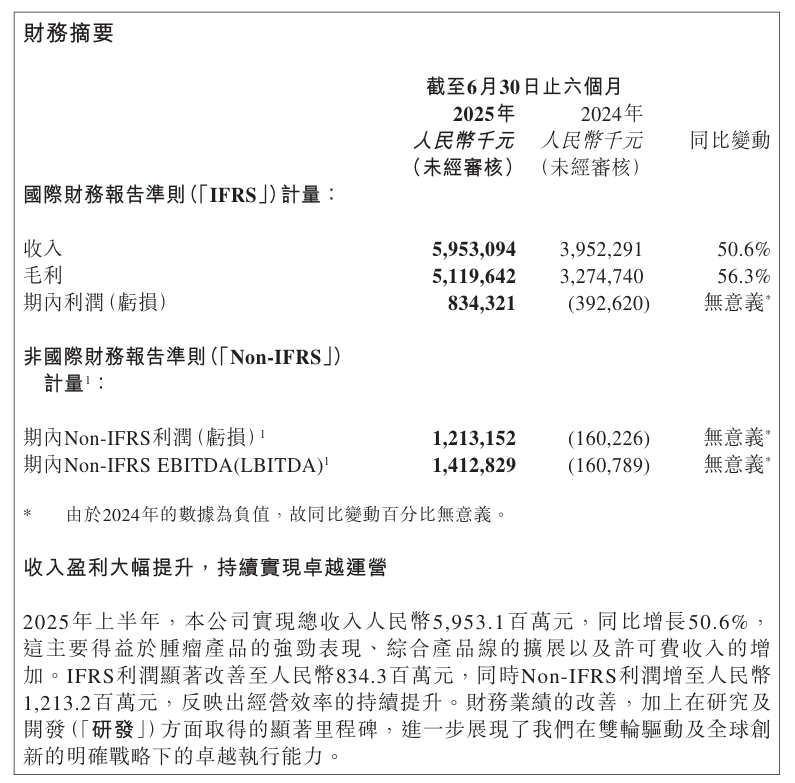
根据财报显示,信达生物上半年营业收入59.53亿元,同比增长50.6%;国际财务报告标准(IFRS)下实现净利润8.34亿元,去年同期亏损3.93亿元。非国际财务报告准则(Non-IFRS)净利润12.13亿元,去年同期亏损1.6亿元。其中,产品销售收入为人民币52.34亿元,同比增长37.3%,贡献核心收入增量;授权费收入达人民币6.66亿元,较去年同期的人民币1.16亿元显著增长,主要来自与罗氏Roche签订独家许可及合作协议所收取的首付款。
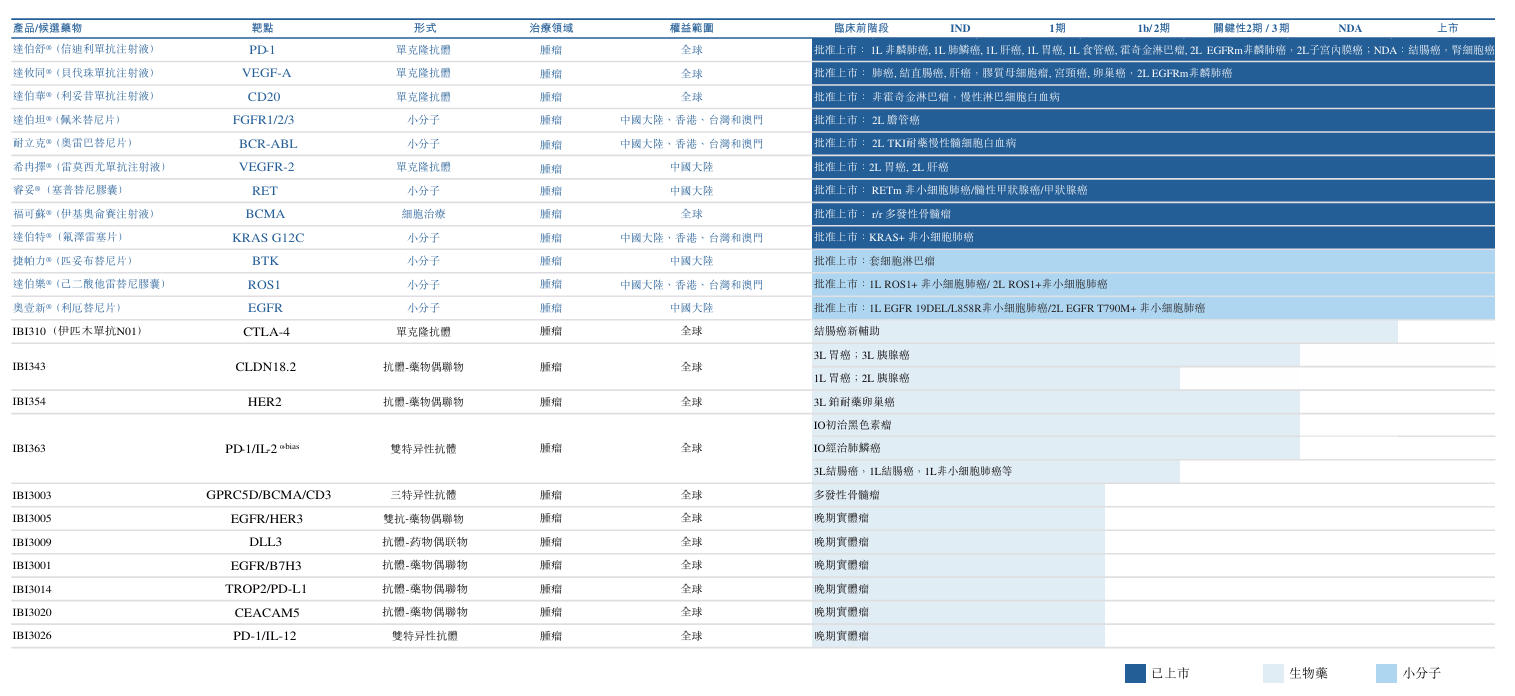
信达生物管线布局具有前瞻性与创新性,通过自主研发与国际合作相结合的方式,构建了丰富且具有差异化竞争力的管线,公司致力于开发治疗癌症、心血管代谢、自身免疫及眼科疾病的开创性疗法。信达已推出16款产品上市,2个品种在NMPA审评中,4个新药分子进入3期或关键性临床研究,另外有15个新药品种已进入临床研究。
在研管线
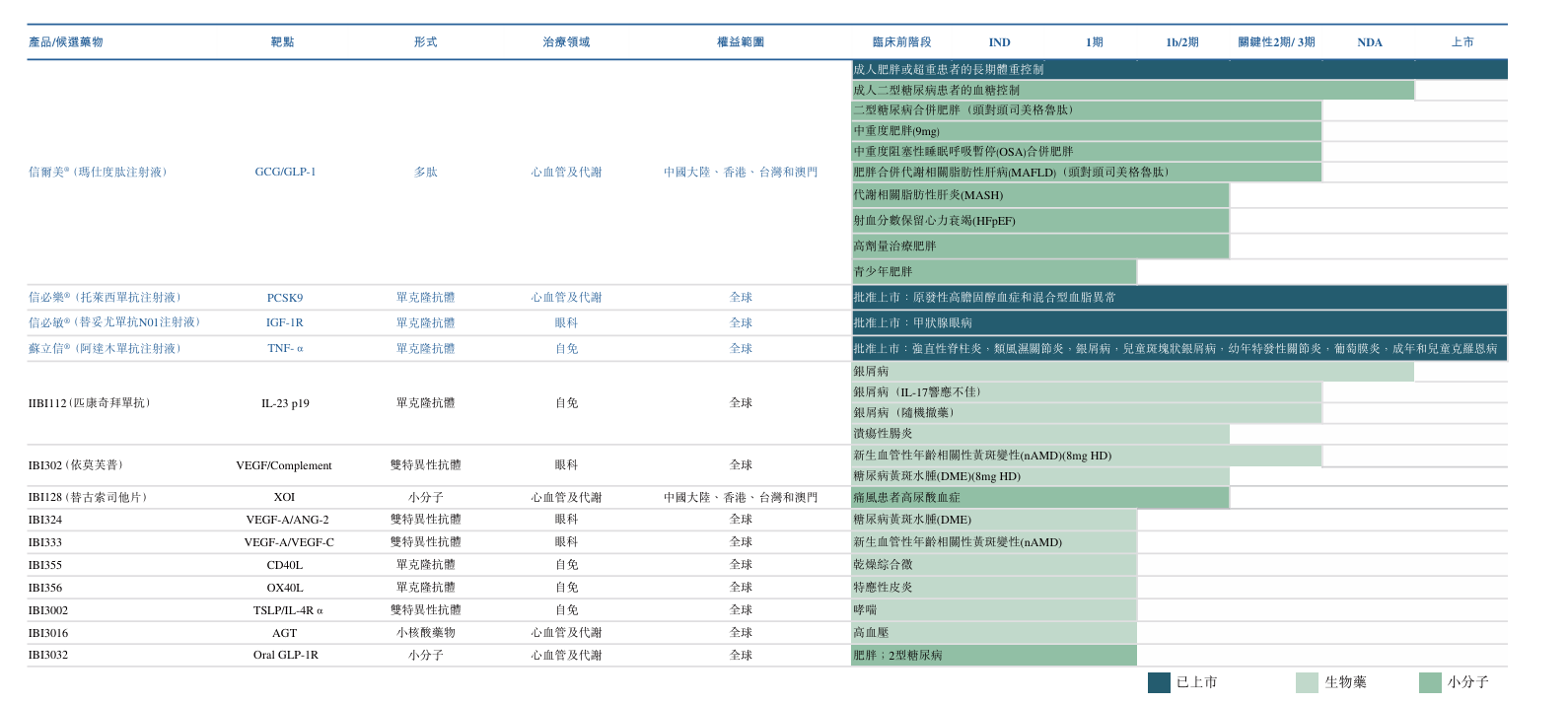
关于IBI363
IBI363 是信达生物自主研发的全球首创PD-1/IL-2α-bias双特异性抗体融合蛋白, 可同时阻断PD-1/PD-L1通路并激活IL-2通路。目前IBI363已进入多项注册临床开发,包括一项针对IO耐 药鳞状NSCLC的全球III期注册临床研究,该研究预计于未来数月内展开; 该适应症已获中国NMPA突破性疗法认定(「BTD」)及美国FDA快速通道资格 (「FTD」)。
关于IBI343
IBI343 是公司自主研发的一款创新型靶向CLDN18.2 的拓扑异构酶 1(TOPO1)抑制剂类ADC,临床数据显示出优异的安全性特征与令人鼓舞的疗 效信号。目前,IBI343正在中国与日本开展针对胃╱胃食管交界处癌的III期 临床研究(G-HOPE-001),该适应症已获中国NMPA BTD;同时,IBI343针对 既往接受过治疗的胰腺导管腺癌 (PDAC) 的全球I/II期临床研究已完成,该适 应症已获中国NMPA BTD及美国FDA FTD。
关于IBI3001
IBI3001 是一款处于I期临床阶段的全球首创靶向B7-H3与EGFR的双抗ADC, 具备多重抗肿瘤机制,包括增强型EGFR阻断作用、受体介导的内化作用, 以及强效ADC介导的细胞毒性,并在临床前模型中展现出高安全治疗窗口。
总结
根据行业内人士表示,第四季度为 BD高峰,我们有望见证更多BD的出现。根据相关统计,中国创新药与 MNC的 BD主要出现在 Q4:24Q4占全年 40%,23Q4 为63%。拓展到中国创新药与所有欧美公司的BD,24Q4为38%,23Q4为44%,可能是 MNC在Q1-Q3偏向于收紧使用 BD quota,而在 Q4可以更自由使用全年剩余额度。因此今年 Q4也有望看到更多 BD发生。
参考来源:
[1] 企业公告
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 信达生物:中国首款TED药物替妥尤单抗获批,盘点国内眼科赛道“抢滩者”
2. 信达生物全球首款双靶点减重药获批,诺和诺德减重新药紧跟
3. 2025年3月236款新药获批临床!54款纳入特殊审评,涉及信达生物,康宁杰瑞…
想要解锁更多药企信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论