
1月6日,药物临床试验登记与信息公示平台官网显示,华海药业子公司华奥泰登记了一项评估 HB0025 联合化疗一线治疗晚期鳞状非小细胞肺癌的III期临床研究。根据公开资料,这是该药启动的首个III期临床研究。
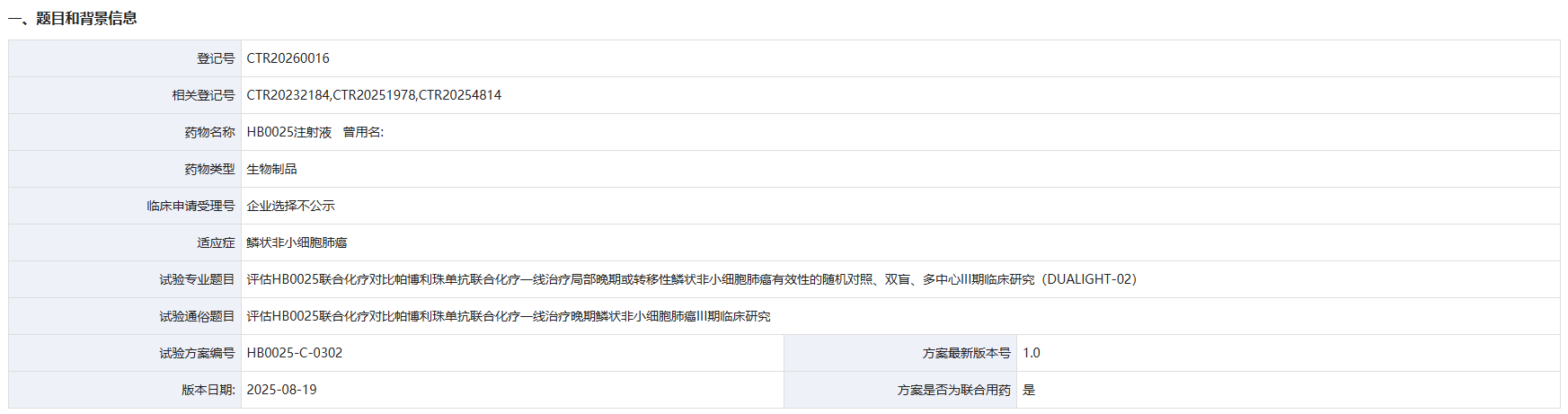
截图来源:药物临床试验登记与信息公示平台官网
这是一项随机对照、双盲、多中心III期临床研究(DUALIGHT-02),旨在评估 HB0025 联合化疗对比 帕博利珠单抗 联合化疗一线治疗局部晚期或转移性鳞状NSCLC的有效性和安全性。该试验拟在国内入组480人,主要终点是盲态独立中心阅片(BICR)依据RECISTv1.1评估的无进展生存期(PFS)。
据摩熵医药数据库显示,HB0025 是由华奥泰自主研发的一款创新型抗PD-L1/VEGF双特异性融合蛋白,同时靶向肿瘤免疫逃逸通路PD-L1和肿瘤血管生成通路VEGF。该药物设计实现了两个靶点的高亲和力结合,协同调控肿瘤免疫微环境与血管生成,具备"免疫增强+抗血管"双重抗肿瘤机制。
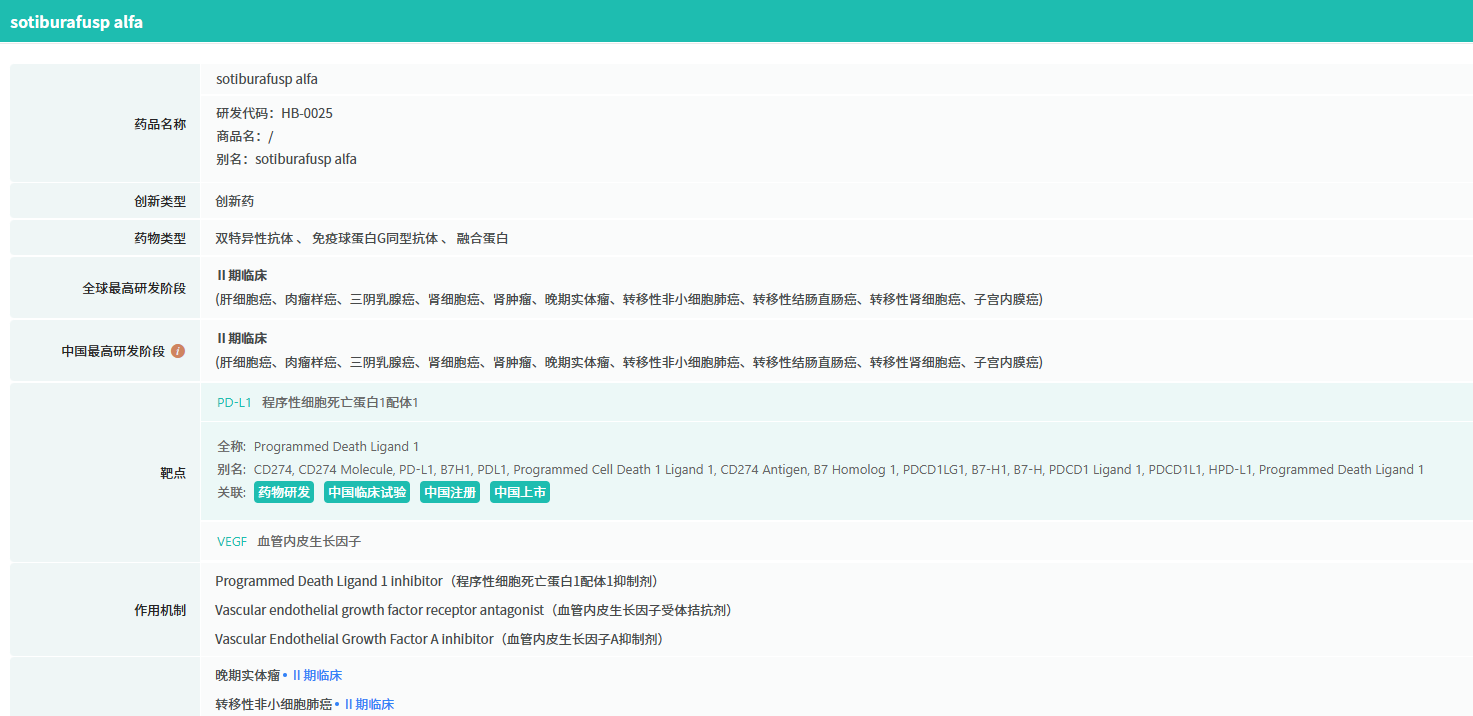
查数据,找摩熵!图源:摩熵医药-全球药物研发数据库
华奥泰在2025年ESMO会议公布的 HB0025 联合化疗一线治疗晚期肺鳞癌和肺腺癌II期临床数据显示,鳞状NSCLC队列客观缓解率(ORR)达83.3%,PD-L1高表达人群ORR高达100%,疾病控制率(DCR)为95.8%。非鳞状队列ORR为56.4%,DCR为94.9%。安全性方面,3级以上免疫相关不良事件(irAEs)发生率低,耐受性良好。
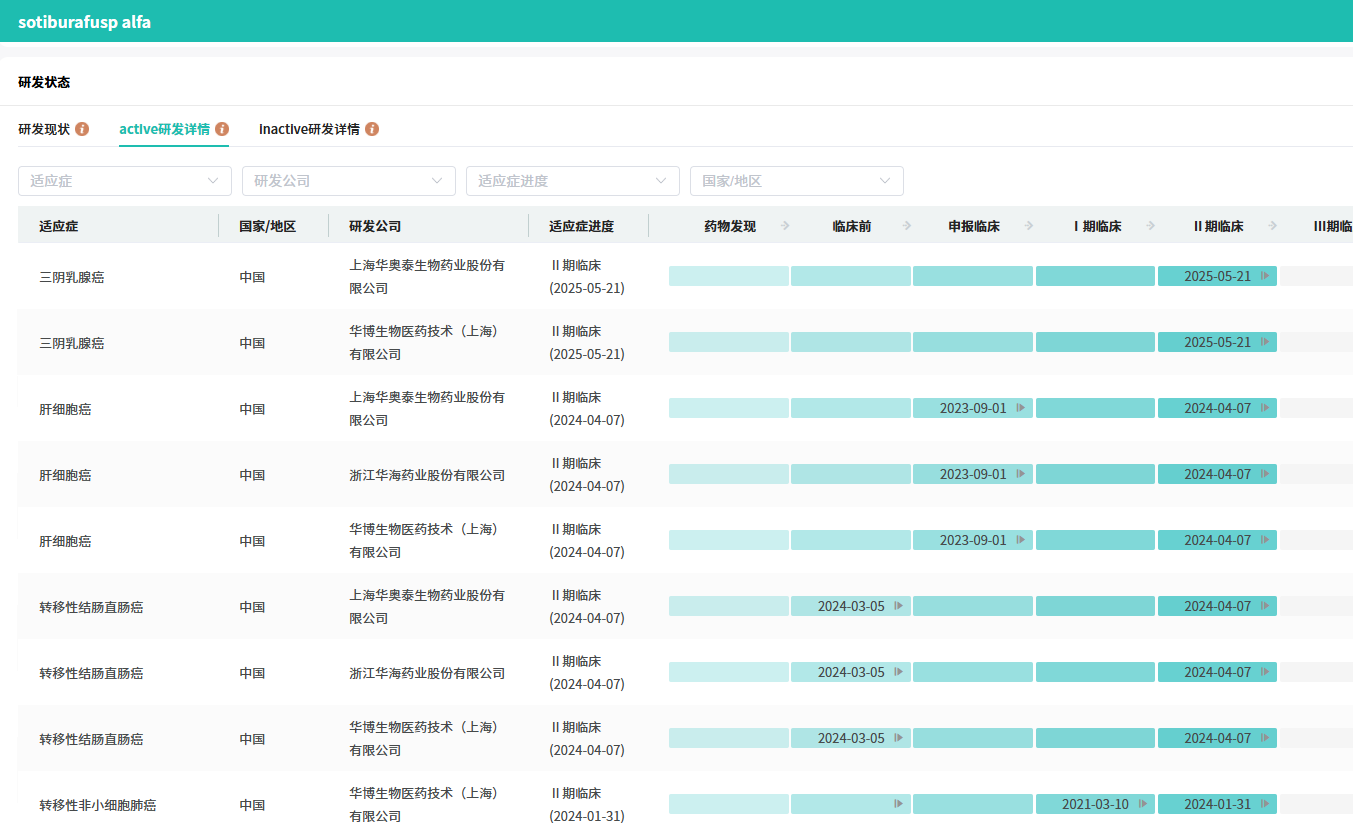
查数据,找摩熵!图源:摩熵医药-全球药物研发数据库
目前,在PD(L)1/VEGF双抗赛道上,康方生物研发的 依沃西单抗 已在中国获批上市。除此之外,华奥泰的 HB0025 、BMS/BioNTech的 PM8002 、辉瑞/三生制药的 SSGJ-707 、神州细胞的 SCTB14 均已进入临床III期。
华海药业已于2025年12月26日公告,子公司华奥泰就 HB0025 联合化疗一线治疗鳞状和非鳞状非小细胞肺癌与CDE召开会议,决定正式启动 HB0025注射液 的III期临床试验。目前,公司已为该项目投入研发费用约3.26亿元。
参考来源:
[1] CDE官网
[2] 摩熵医药(原药融云)数据库
[3] 企业官网/官方公告
扩展阅读:
1. Myovant子宫肌瘤新药RelugolixⅢ期临床结果阳性
2. 百奥赛图/祐和医药YH001和YH003二期临床试验双双获得FDA批准
查数据,找摩熵!想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论