
4月23日,康方生物(9926.HK)宣布,其全球首创双特异性抗体新药依沃西单抗注射液(商品名:依达方,PD-1/VEGF 双抗),在联合化疗对比替雷利珠单抗联合化疗,一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC)的注册性 III 期临床研究(AK112-306/HARMONi-6)中取得佳绩。

经独立数据监察委员会(IDMC)评估的期中分析显示强阳性结果:达到无进展生存期(PFS)的主要研究终点,研究结果具有统计学显著获益和重大临床获益。
23日一早开盘,康方生物股价涨超13%,高见99.9港元,创历史新高。截至发稿,涨6.6%。
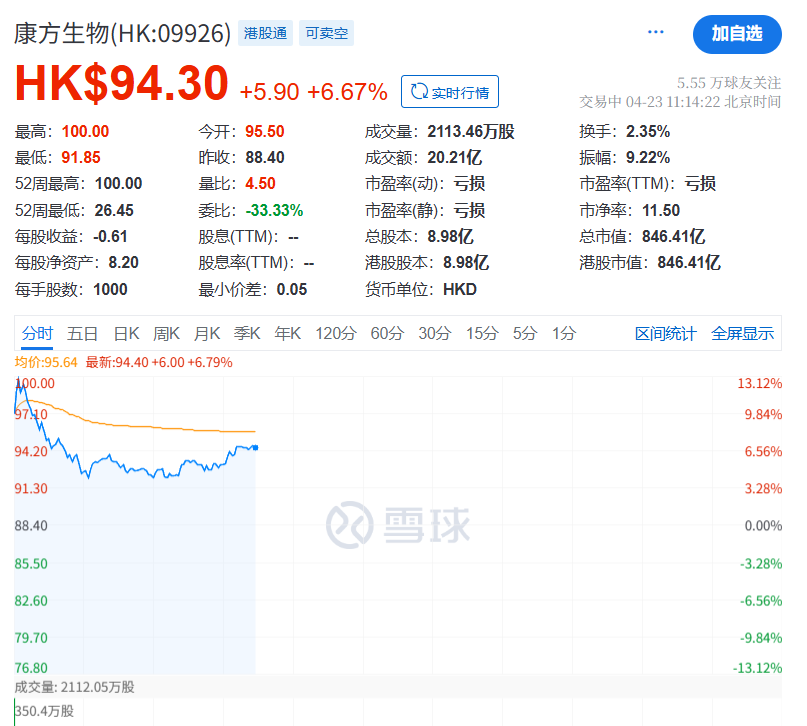
在此次头对头试验中,依沃西联合化疗把替雷利珠单抗联合化疗作为对照组。康方生物表示,HARMONi-6临床试验共入组532例受试者,中央型鳞癌占比约为63%,与真实世界患者分布一致。研究数据表明,在意向治疗人群(ITT)中,依沃西联合化疗组的患者无进展生存期(PFS)相较对照组,获得了决定性胜出的阳性结果。
在安全性方面,依沃西组总体表现良好,未发现新的安全性信号。与治疗相关的严重不良反应发生率以及三级及以上出血事件发生率与对照组相似。这意味着依沃西单抗在显著提升疗效的同时,并未增加患者的不良反应风险,为临床应用提供了重要的安全保障。
资料显示,HARMONi-6研究是依沃西在非小细胞肺癌领域取得的第3个显著阳性结果的III期临床研究,填补了抗血管生成机制药物在sq-NSCLC中不可用的巨大临床空白。这也是依沃西第2个与PD-1疗法“头对头”取得阳性结果的III期临床研究。
此前,依沃西在单药“头对头”III期临床研究中,证明疗效显著优于K药,被《柳叶刀》评价为“肿瘤免疫治疗领域的重大突破”。此外,高盛在一份研报中大胆预测:依沃西单抗2041年的峰值销售额约可达530亿美元。

依沃西(PD-1/VEGF)是康方生物自主研发的全球首创PD-1/VEGF双特异性肿瘤免疫治疗药物,于2024年5月24日获得国家药品监督管理局(NMPA)批准上市,用于治疗经EGFR-TKI治疗后进展的EGFR突变的局部晚期或转移性非鳞状NSCLC。
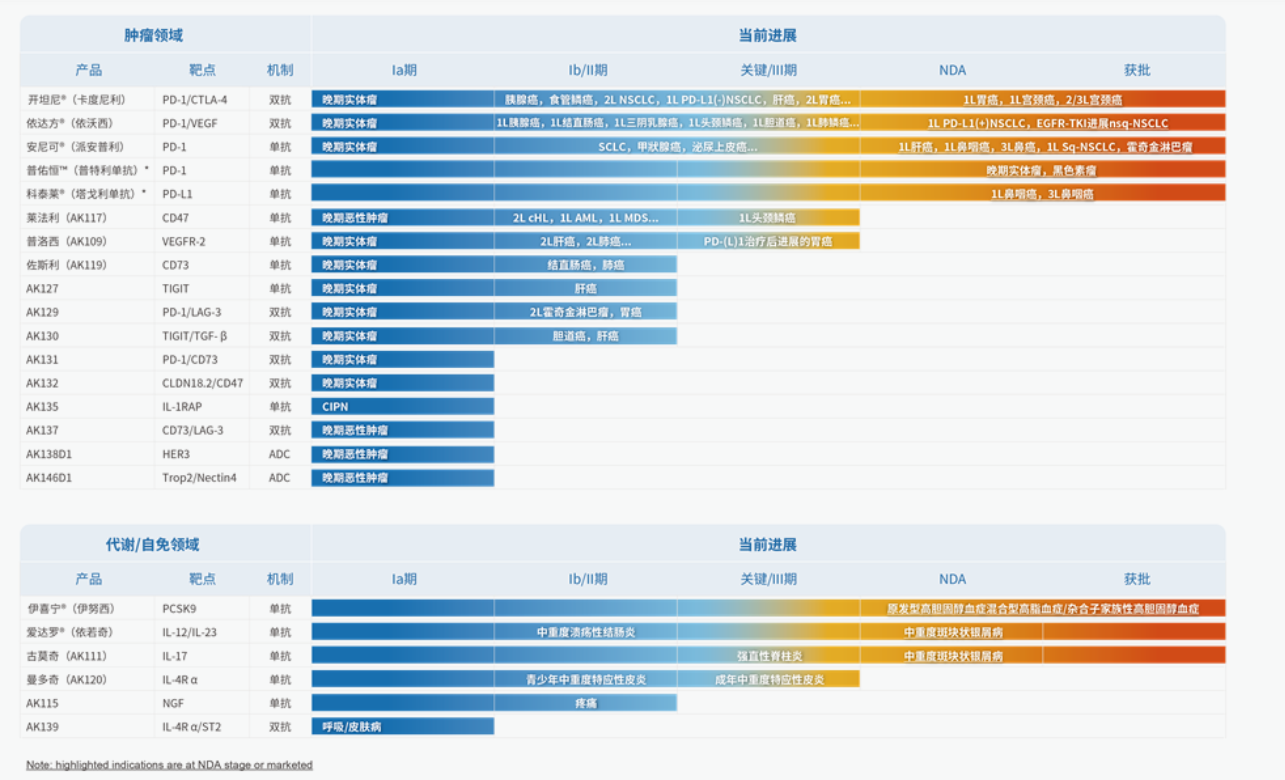
康方生物(9926.HK)是一家集研究、开发、生产及商业化全球首创或同类最佳创新生物新药于一体的领先企业。公司已开发了50个以上用于治疗肿瘤、自身免疫、炎症、代谢疾病等重大疾病的创新候选药物,24个候选药已进入临床(包括15个双抗/多抗/双抗ADC),7个新药已在商业化销售,4个新药4个适应症的上市申请处于审评审批阶段。
在研管线
2024年康方生物收入21.24亿元,同比下滑53.08%;归属股东应占溢利-5.145亿元人民币,较上年由盈利转为亏损。
不过,其商业销售收入表现比较稳定,扣除分销成本后的商业销售收入总额为20.02亿元,同比增长24.88%。而这一增长主要得益于开坦尼®(卡度尼利,PD-1/CTLA-4)销售的持续增长以及依达方®(依沃西,PD-1/VEGF)在去年5月获批上市后带来的积极销售贡献。具体销售数据此次财报未予披露。























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论