1.4.1本周全球TOP10创新药研发进展
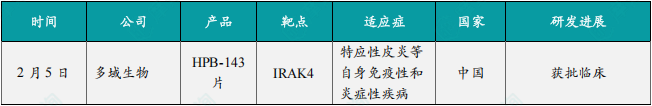
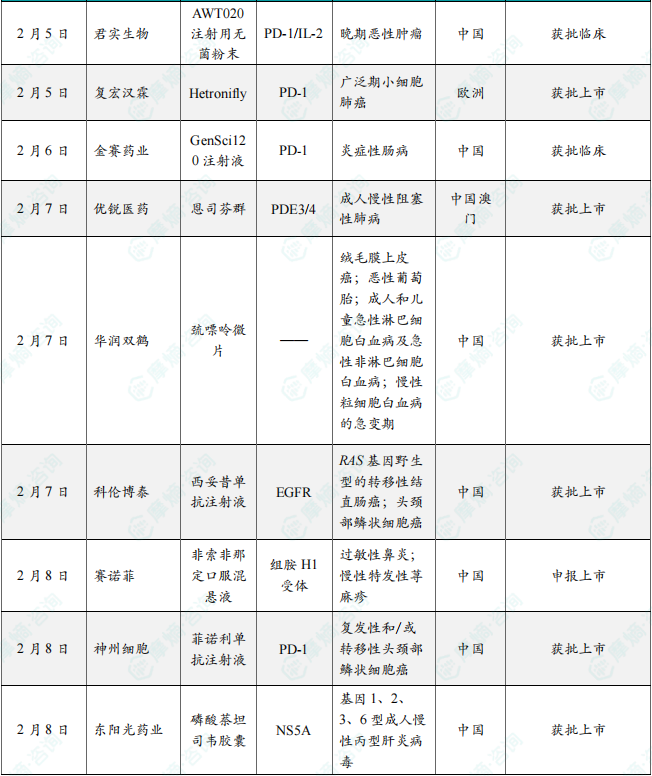
(1)多域生物1类新药HPB-143片在中国获批临床,针对特应性皮炎
2月5日,CDE官网最新公示,多域生物(Polymed Biopharma)申报的1类新药HPB-143片获得临床试验默示许可,拟开发治疗特应性皮炎等自身免疫性和炎症性疾病。根据多域生物公开资料,这是一款靶向IRAK4的蛋白降解靶向嵌合体(以下简称PROTAC)。该产品此前已经于2024年10月在美国获批临床,本次是该产品首次在中国获批IND。根据多域生物此前新闻稿介绍,其开发的HPB-143具有较高的口服给药生物利用度(小鼠中达到49%);对hERG没有抑制活性,具有更高的人体心脏安全性;在小鼠特应性皮炎疾病模型中,HPB-143的起效剂量更低、药效更优。此外,HPB-143在银屑病、急性溃疡性结肠炎等自身免疫疾病模型中均有明显的治疗效果。
(2)君实生物双靶点癌症1类新药在中国获批临床
2月5日,CDE官网最新公示,由君实生物申报的1类新药AWT020注射用无菌粉末获批临床,拟开发治疗晚期恶性肿瘤。公开资料显示,这是一款抗PD-1/IL-2c融合蛋白。AWT020(aPD1-IL-2c)是Anwita Biosciences公司研发管线中的一款产品,目前正在澳大利亚开展1期临床研究。此前早在2020年9月,君实生物就与Anwita Biosciences达成合作,后者授予君实生物在大中华区单独使用IL-2系列产品及相关技术的独占许可。目前,双方正在合作开发Exenokine-21(JS014,长效IL-21纳米抗体融合蛋白)等产品。在临床前研究中,aPD1-IL-2c表现出较好的单药抗肿瘤活性,具有强大的免疫记忆,并伴有肿瘤内功能性T细胞的优先激活和扩增。在非人类灵长类动物中,aPD1-IL-2c在支持临床计划的剂量水平下具有良好的耐受性。
(3)复宏汉霖抗PD-1单抗在欧盟获批上市,治疗广泛期小细胞肺癌
2月5日,复宏汉霖宣布,抗PD-1单抗斯鲁利单抗(H药,欧洲商品名:Hetronifly)正式获得欧盟委员会(EC)批准,联合卡铂和依托泊苷用于广泛期小细胞肺癌(ES-SCLC)成人患者的一线治疗。复宏汉霖新闻稿表示,这标志着H药成为首个在欧盟获批上市用于广泛期小细胞肺癌治疗的抗PD-1单抗。本次H药获EC批准主要基于ASTRUM-005研究,ASTRUM-005研究是一项随机、双盲、安慰剂对照的国际多中心3期研究,ASTRUM-005研究数据显示,截至2021年10月22日,斯鲁利单抗组的中位总生存期(OS)达到15.4个月,相比安慰剂组的10.9个月有明显延长。同时,斯鲁利单抗组的24个月总生存率达到43.1%(vs 7.9%),经独立影像评估委员会(IRRC)依据RECIST v1.1评估的中位无进展生存期(PFS)为5.7个月(vs 4.3个月)。
(4)金赛药业1类新药GenSci120注射液获批临床,拟开发治疗炎症性肠病
2月6日,CDE官网最新公示,金赛药业申报的1类新药GenSci120注射液获得一项新的临床试验默示许可,拟开发治疗炎症性肠病(IBD),包括溃疡性结肠炎(UC)和克罗恩病(CD)。公开资料显示,GenSci120注射液是一款PD-1激动剂抗体新药,该产品已于今年1月首次在中国获批临床,用于开展治疗成人系统性红斑狼疮、成人原发性干燥综合征的临床试验。根据金赛药业此前新闻稿介绍,GenSci120是该公司研发的人源化抗PD-1单克隆抗体,抗体类型为IgG1,通过和PD-1结合并激活PD-1抑制性信号通路以及ADCC效应,从而抑制或杀伤致病性T细胞,发挥相对特异的靶向免疫抑制作用。临床前试验表明,GenSci120注射液能发挥相对特异的靶向免疫抑制作用,展现出潜在治疗自身免疫病的成药性。
(5)优锐医药慢阻肺吸入疗法恩司芬群在中国澳门地区获批上市
2月7日,优锐医药(Nuance Pharma)宣布,恩司芬群(ensifentrine)已获得中国澳门特别行政区药物管理局的批准,用于成人慢性阻塞性肺病(COPD)的维持治疗。恩司芬群是一款“first-in-class”吸入型磷酸二酯酶3、4(PDE3&PDE4)双靶点抑制剂,双重抑制机理使其能够凭借单个化合物同时实现支气管扩张以及抗炎效应。此外,该产品可通过普通雾化器直接递送到肺部,使用简便,不需要复杂的手口协调操作。此次获批基于包括全球3期ENHANCE临床试验在内的广泛数据,在ENHANCE临床试验中,恩司芬群无论单独使用还是与其他维持疗法联合使用,均显示出临床益处。此外,该产品在中度至重度COPD患者中耐受性良好。
(6)华润双鹤改良型新药巯嘌呤微片获批上市,用于绒毛膜上皮癌/恶性葡萄胎/白血病
2月7日,NMPA官网最新公示,华润双鹤申报的改良型新药巯嘌呤微片的上市申请已获得批准。根据中国国家药监局药品审评中心(CDE)优先审评公示,这是一款可精准计量的创新剂型巯嘌呤微片(5mg规格),“体型”缩至芝麻大小。该药本次获批的适应症为:绒毛膜上皮癌,恶性葡萄胎,成人和儿童急性淋巴细胞白血病及急性非淋巴细胞白血病,慢性粒细胞白血病的急变期。巯嘌呤属于抑制嘌呤合成途径的细胞周期特异性药物,是一种硫嘌呤类化疗药物,实施个体化给药将提高巯嘌呤的疗效和安全性。根据华润双鹤此前公开资料介绍,目前临床已有的巯嘌呤规格为50mg片剂,直径约1厘米,儿童需按每公斤体重计算服用剂。
(7)科伦博泰西妥昔单抗注射液生物类似药获批上市,用于结直肠癌及头颈部鳞状细胞癌
2月7日,NMPA官网最新公示,科伦博泰开发的西妥昔单抗注射液生物类似药(A140)的上市申请已于近日获得批准。根据科科伦博泰此前新闻稿,该产品本次获批适应症为:1)用于治疗RAS基因野生型的转移性结直肠癌,包括与FOLFOX或FOLFIRI化疗方案联合用于一线治疗,以及与伊立替康联合用于经含伊立替康治疗失败后的患者;2)用于治疗头颈部鳞状细胞癌,包括与铂类和氟尿嘧啶化疗联合用于一线治疗复发和/或转移性疾病,以及与放疗联合用于治疗局部晚期疾病。西妥昔单抗是一种靶向作用于EGFR的单克隆抗体,通过与EGFR特异性结合,抑制受体激活以及后续的信号传导通路,从而减少肿瘤细胞对正常组织的侵袭及阻碍肿瘤扩散到新的位点。此次科伦博泰这款西妥昔单抗生物类似药在中国获批上市,有望给一些癌症疾病患者带来更多治疗选择。
(8)赛诺菲抗过敏药非索非那定新剂型在中国申报上市
2月8日,CDE官网最新公示,赛诺菲(Sanofi)申报的盐酸非索非那定口服混悬液上市申请获得受理。公开资料显示,非索非那定是一款二代新型抗组胺药。此前非索非那定片已经在中国获批,治疗过敏性鼻炎及慢性特发性荨麻疹。本次申报上市的为口服混悬液剂型。根据赛诺菲此前新闻稿介绍,非索非那定是二代新型抗组胺药,具有起效快、24小时长效,且不引起嗜睡,脑部受体占有率低等特点。其对H1受体的亲和力较高,表明其较好的心脏安全性。目前,赛诺菲已经针对该产品开发了胶囊、片剂、复方制剂等多种剂型。公开资料显示,口服混悬液相比于片剂剂型,有可能帮吞咽困难的人提供更方便的治疗选择。
(9)神州细胞抗PD-1单抗癌症新药国内获批上市
2月8日,NMPA官网最新公示,神州细胞申报的1类新药菲诺利单抗注射液上市申请已获得批准,获批适应症为与含铂化疗联合用于复发性和/或转移性头颈部鳞状细胞癌的一线治疗。菲诺利单抗(finotonlimab,产品代号为SCT-I10A)为抗PD-1的功能性单克隆抗体,可通过阻断PD-1与其配体的结合,改变肿瘤微环境,恢复和提高T细胞的免疫杀伤功能,从而抑制肿瘤的生长。2024年7月,神州细胞宣布了菲诺利单抗联合化疗(顺铂+5FU,C5F)晚期一线治疗头颈部鳞癌患者的3期研究结果,结果显示菲诺利单抗联合化疗与单纯化疗组相比可显著改善患者OS(14.1个月 vs 10.5个月)以及客观缓解率(ORR,39.9% vs 29.4%)。
(10)东阳光药抗丙肝1类创新药磷酸萘坦司韦获批上市
2月8日,NMPA官网最新公示,批准东阳光药业1类创新药磷酸萘坦司韦胶囊上市,该药适用于与艾考磷布韦片联用,治疗初治或干扰素经治的基因1、2、3、6型成人慢性丙型肝炎病毒(HCV)感染,可合并或不合并代偿性肝硬化。根据东阳光药公开资料,磷酸萘坦司韦为NS5A抑制剂,艾考磷布韦为NS5B抑制剂,这两款药均为东阳光药自主研发的1类新药。根据东阳光药此前新闻稿介绍,磷酸萘坦司韦+艾考磷布韦可覆盖基因1、2、3a和6型丙肝患者,这些基因型占据了中国大部分丙肝患者,该联合疗法治疗慢性丙肝的2期临床研究结果显示总体SVR12为96.7%;按基因型总结,该方案在基因1型、2型、3型和6型受试者中SVR12分别为96.2%、100.0%、83.3%、100.0%。
1.4.2本周全球TOP10积极/失败临床结果
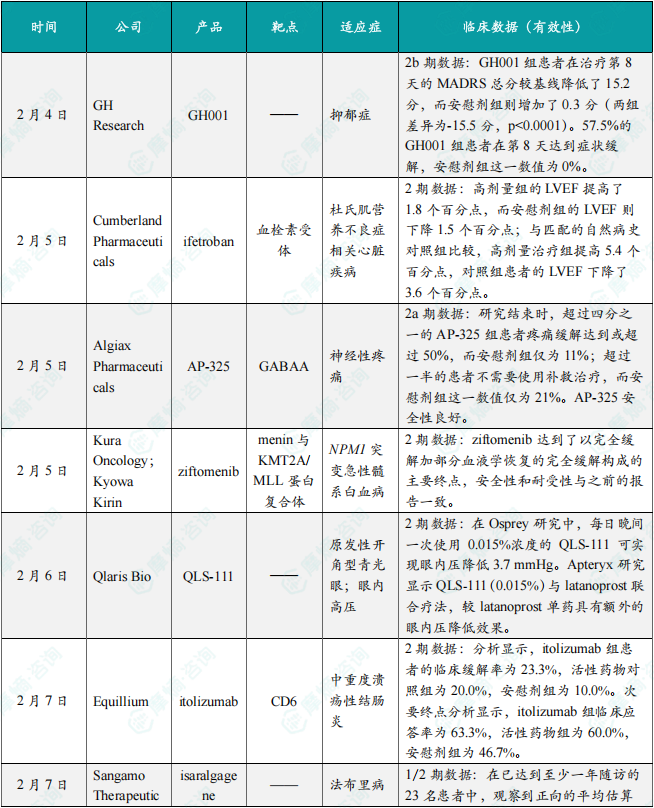
(1)GH Research公司在研GH001 2b期临床试验达到临床主要终点,用于治疗抑郁症
2月4日,GH Research宣布,在研疗法GH001,在一项针对难治性抑郁症(TRD)患者的随机双盲、安慰剂对照的2b期临床试验(GH001-TRD-201)中,达到了临床主要终点。GH001是一种吸入式给药的5-MeO-DMT(属于色胺家族的一种致幻天然产物)。分析显示,GH001组患者在治疗第8天的蒙哥马利-阿斯伯格抑郁评定量表(MADRS)总分较基线降低了15.2分,而安慰剂组则增加了0.3分(两组差异为-15.5分,p<0.0001)。57.5%的GH001组患者在第8天达到症状缓解(remission),安慰剂组这一数值为0%。患者接受GH001治疗后出院时未观察到解离状态或镇静现象,97.4%的患者在接受最后一次给药后1小时内即具备出院条件。患者出院后无需遵守任何限制措施。
(2)Cumberland公司创新口服疗法ifetroban 2期临床试验获得积极顶线结果
2月5日,Cumberland公司宣布,其2期临床试验FIGHT DMD获得积极顶线结果。该研究评估了在研创新口服疗法ifetroban治疗杜氏肌营养不良症(DMD)相关心脏疾病的疗效和安全性。新闻稿指出,这项试验是首个专门针对DMD心脏并发症的成功2期临床试验,代表着这一领域的重要突破。Ifetroban是一种每日一次的口服药物,通过阻断在炎症和纤维化过程中发挥关键作用的血栓素(thromboxane)受体发挥作用。分析显示,高剂量组的LVEF提高了1.8个百分点,而安慰剂组的LVEF则下降1.5个百分点;与匹配的自然病史对照组比较,高剂量治疗带来了更为显著的LVEF改善(提高5.4个百分点),对照组患者的LVEF下降了3.6个百分点。
(3)Algiax公司在研疗法AP-325在治疗神经性疼痛的2a期临床试验获得积极顶线结果
2月5日,Algiax Pharmaceuticals公司宣布在研疗法AP-325在治疗神经性疼痛的2a期临床试验中获得积极顶线数据。AP-325是一种非阿片类小分子药物,旨在通过激活GABAA信号通路来缓解神经性疼痛。AP-325的设计目标是治疗大部分神经性疼痛患者,并且由于其不穿越血脑屏障,因此不会引起镇静作用,AP-325的成瘾或滥用潜力较低。分析显示,在治疗不足两周内,疼痛强度数字评估量表(PI-NRS)显示具有临床意义的疼痛缓解;接受AP-325治疗的患者中,获得≥50%和≥70%疼痛缓解的患者比例明显高于安慰剂组。研究结束时,超过四分之一的AP-325组患者疼痛缓解达到或超过50%,而安慰剂组仅为11%。在AP-325组中,超过一半的患者不需要使用补救治疗,而安慰剂组这一数值仅为21%。AP-325安全性良好,观察到的不良反应与安慰剂组相当,且无中枢系统不良反应(包括镇静、嗜睡或头晕)。
(4)Kura Oncology & Kyowa Kirin小分子疗法ziftomenib在2期临床试验中取得积极顶线结果
2月5日,Kura Oncology与Kyowa Kirin宣布,在研疗法ziftomenib,在治疗复发/难治性(R/R)NPM1突变(NPM1-m)急性髓系白血病(AML)患者的注册性2期临床试验KOMET-001中取得积极的顶线结果。Ziftomenib是一种高选择性、每日一次口服的在研menin抑制剂,是一种针对menin与KMT2A/MLL蛋白复合体之间相互作用的候选药物,用于治疗有高度未满足需求,携带特定基因突变的AML患者。分析显示,ziftomenib达到了以完全缓解(CR)加部分血液学恢复的完全缓解(CRh)构成的主要终点。Ziftomenib的风险获益比令人鼓舞,其安全性和耐受性与之前的报告一致。
(5)Qlaris Bio公司QLS-111达两项试验所有主、次要终点
2月6日,Qlaris Bio宣布了两项临床2期试验Osprey与Apteryx的初步积极结果。这两项试验评估了QLS-111在原发性开角型青光眼(POAG)和眼内高压(OHT)患者中的疗效。QLS-111是一种潜在“first-in-class”的新型局部制剂,采用Qlaris Bio专有的ATP敏感性钾通道调节平台开发。QLS-111通过松弛位于小梁网远端的血管及类血管组织,从而降低远端房水流出阻力并降低眼内血管压力(EVP),达到降低眼内压的效果。分析显示,在Osprey研究中,每日晚间一次(QPM)使用0.015%浓度的QLS-111可实现最大的眼内压降低,幅度可达3.7 mmHg。Apteryx研究显示QLS-111(0.015%)与latanoprost联合疗法,较latanoprost单药具有额外的眼内压降低效果,其中QLS-111 QPM给药组患者的眼内压额外降低3.2 mmHg,而接受每日两次QLS 111治疗患者的眼内压则额外降低3.6 mmHg。
(6)Equillium公司itolizumab临床2期研究获得积极结果,用于溃疡性结肠
2月7日,Equillium宣布其潜在“first-in-class”疗法itolizumab用于治疗中重度溃疡性结肠炎(UC)的临床2期研究获得积极结果。Itolizumab是一种在研、潜在“first-in-class”的CD6靶向单克隆抗体,可选择性靶向CD6-ALCAM信号通路,选择性抑制致病性效应T细胞,同时保留对维持平衡免疫反应至关重要的调节性T细胞。分析显示,itolizumab组患者的临床缓解率为23.3%,活性药物对照组为20.0%,安慰剂组为10.0%。次要终点分析显示,itolizumab组临床应答率为63.3%,活性药物组为60.0%,安慰剂组为46.7%。此外,itolizumab组的内镜缓解率为16.7%,活性药物组为16.7%,安慰剂组为6.7%。Itolizumab总体耐受性良好,未观察到安全性信号。
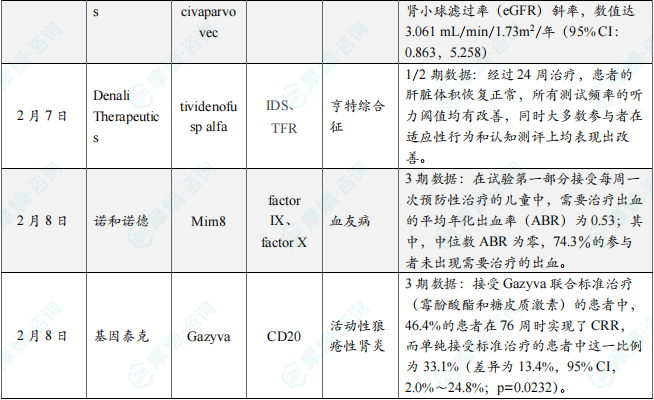
(7)Sangamo公司创新基因疗法公布临床1/2期研究最新数据,用于法布里病
2月7日,Sangamo Therapeutics公布了进行中的临床1/2期试验STAAR的最新数据,该研究评估其在研基因疗法isaralgagene civaparvovec(ST-920)用于治疗法布里病的结果。Isaralgagene civaparvovec使用重组AAV2/6载体,将表达α-半乳糖苷酶A的GLA基因递送到肝脏,旨在通过一次性治疗获得持久疗效,减轻ERT输注负担。分析显示,治疗时间最长的患者其α-半乳糖苷酶A的活性持续升高并维持近四年(47个月),显示该疗法具有持久益处。在已达到至少一年随访的23名患者中,观察到正向的平均估算肾小球滤过率(eGFR)斜率,数值达3.061 mL/min/1.73m2/年(95% CI:0.863,5.258),显示患者的肾功能有显著改善。此外,所有18名在研究启动时接受标准治疗ERT的患者均已停止ERT的治疗,并且目前仍未恢复使用ERT。
(8)Denali公司突破性疗法公布临床1/2期研究最新数据,用于亨特综合征
2月7日,Denali Therapeutics公司公布了在研疗法tividenofusp alfa(DNL310),在47名亨特综合征(MPS II)患者中进行的1/2期临床试验的主要分析结果。Tividenofusp alfa是一款由人艾杜糖-2-硫酸酯酶(IDS)与Denali的酶转运载体(ETV)结合的融合蛋白药物。分析显示,tividenofusp alfa将患者脑脊液中的硫酸乙酰肝素(heparan sulfate)水平降低到正常水平,与溶酶体功能和神经退行性病变相关的生物标志物指标也得到改善。经过24周治疗,患者的肝脏体积恢复正常,所有测试频率的听力阈值均有改善,同时大多数参与者在适应性行为和认知测评上均表现出改善。
(9)诺和诺德长效血友病双抗疗法Mim8 3期临床试验获得积极中期结果
2月8日,诺和诺德(Novo Nordisk)宣布,在研长效血友病A疗法Mim8,在针对70名患有血友病A(体内有和无凝血因子抑制物)的1至11岁儿童所进行的3期临床试验FRONTIER3中获得积极中期结果。Mim8是一种模拟凝血因子VIIIa(FVIIIa)的在研双特异性抗体,旨在为血友病A患者提供持续止血效果,可用于每周一次、每两周一次或每月一次的预防性治疗。分析显示,在试验第一部分接受每周一次预防性治疗的儿童中,需要治疗出血的平均年化出血率(ABR)为0.53;其中,中位数ABR为零,74.3%的参与者未出现需要治疗的出血。所有携带凝血因子抑制物的血友病A儿童(n=14)均未报告发生需要治疗的出血。在第26周时,98%的护理者表示他们更倾向于使用Mim8而非之前的治疗,其中73%的护理者表示“非常强烈”地倾向使用Mim8。
(10)基因泰克公布抗CD20抗体疗法Gazyva 3期临床结果,治疗活动性狼疮性肾炎
2月8日,基因泰克(Genentech)公司宣布了抗CD20抗体疗法Gazyva(obinutuzumab)治疗活动性狼疮性肾炎患者的3期临床试验REGENCY的详细分析结果。Gazyva是一种抗CD20人源化单克隆抗体,CD20是某些类型B细胞表达的蛋白质。分析显示,接受Gazyva联合标准治疗(霉酚酸酯和糖皮质激素)的患者中,46.4%的患者在76周时实现了CRR,而单纯接受标准治疗的患者中这一比例为33.1%(差异为13.4%,95% CI,2.0%~24.8%;p=0.0232)。同时,补体水平的显著改善以及抗双链DNA抗体水平的降低表明疾病活动性和炎症均得到了具有临床意义的改善。新闻稿指出,Gazyva是首个在狼疮性肾炎随机3期临床试验中显示出CRR益处的抗CD20单克隆抗体。
同期事件:
1. 2025年第6周02.03-02.09国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第6周02.03-02.09国内仿制药/生物类似物申报/审批数据分析
3. 2025年第6周02.03-02.09国内医药大健康行业政策法规汇总
以上内容均来自{摩熵咨询医药行业观察周报(2025.02.03-2025.02.09)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论