1.4.1本周全球TOP10创新药研发进展
(1)阿斯利康/第一三共重磅ADC疗法Enhertu有望在欧盟获批,针对乳腺癌
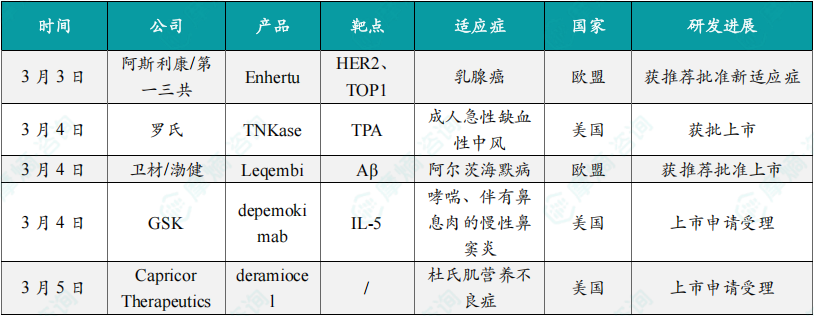
3月3日,阿斯利康与第一三共日前共同宣布,其联合开发的重磅抗体偶联药物Enhertu获得欧洲药品管理局人用药品委员会(CHMP)推荐在欧盟获批,作为单药用于治疗不可切除或转移性激素受体(HR)阳性、HER2低表达或HER2极低表达的乳腺癌成人患者。CHMP的积极意见基于3期临床试验DESTINY‐Breast的结果,在该试验中,对于未接受化疗的HR阳性、HER2低表达转移性乳腺癌患者,Enhertu与化疗相比将患者疾病进展或死亡风险降低38%,Enhertu组的中位无进展生存期(PFS)为13.2个月,而化疗组为8.1个月。Enhertu是阿斯利康和第一三共联合开发的ADC疗法,之前新闻稿指出,Enhertu是首款具有不限癌种适应症的HER2靶向ADC疗法。
(2)罗氏创新疗法血栓溶解剂TNKase获美国FDA批准上市,成为近30年来首款中风新药
3月4日,罗氏旗下基因泰克今日宣布,美国FDA已批准血栓溶解剂TNKase(tenecteplase)上市,用于治疗成人急性缺血性中风。TNKase是一种组织纤溶酶原激活剂,具有溶解血栓的作用。TNKase以一次五秒的静脉推注给药,启动一种能够分解血栓成分纤维蛋白的生化反应。此次批准基于一项大型多中心非劣效性研究,这项临床试验比较了TNKase和Activase在治疗表现出致残性神经缺陷的急性缺血性中风患者时的表现。研究结果显示,在急性缺血性中风患者中,TNKase在安全性和疗效方面与Activase相当。新闻稿指出,TNKase是FDA近30年来批准的首款中风药物。
(3)卫材/渤健阿尔茨海默病新药Leqembi有望在欧盟获批,审评意见积极
3月4日,卫材和渤健日前宣布,欧洲药品管理局人用药品委员会(CHMP)已再度确认对其联合开发的阿尔茨海默病疗法Leqembi(lecanemab)的积极意见,推荐它用于治疗确诊为阿尔茨海默病导致的轻度认知障碍和轻度痴呆(早期阿尔茨海默病)的成人患者。Leqembi可与β淀粉样蛋白的可溶性寡聚体特异性结合。在AD患者大脑中,β淀粉样蛋白的水平升高会促使它们从单体聚集成为二聚体和可溶性寡聚体,最终进一步聚集成为大脑中的淀粉样蛋白沉积。科学研究显示,β淀粉样蛋白的可溶性寡聚体表现出比单体更强的细胞毒性。Leqembi通过与它们结合,可中和并清除具有毒性的可溶性寡聚体。Leqembi目前已在美国、日本、中国、韩国、以色列、阿联酋和英国等国家和地区获得批准。
(4)GSK超长效疗法IL-5抑制剂德莫奇单抗有望在美国获批,针对哮喘、慢性鼻窦炎
3月4日,GSK宣布,美国FDA已受理其在研疗法depemokimab用于两项适应症的生物制品许可申请,包括作为附加维持疗法,用以治疗12岁及以上具2型炎症特征的成人和青少年哮喘患者;以及作为附加维持疗法,用以治疗伴有鼻息肉的慢性鼻窦炎成人患者。Depemokimab是一款在研白细胞介素-5(IL-5)靶向的超长效生物制品。Depemokimab能够与IL-5以高亲和力结合,以每六个月给药一次的频率用以治疗重度哮喘患者。根据新闻稿,如果获批,depemokimab将成为仅须每6个月给药一次的首个获批超长效生物制品。值得一提的是,该疗法曾获行业媒体Evaluate评估为有望在2025年获批上市的潜在重磅疗法。
(5)Capricor Therapeutics潜在“first-in-class”疗法有望在美国获批,针对杜氏肌营养不良症
3月5日,Capricor Therapeutics公司宣布,美国FDA已受理其为潜在“first-in-class”细胞疗法deramiocel递交的生物制品许可申请,用于治疗患有杜氏肌营养不良症心肌病的患者。Deramiocel是一种同种异体细胞疗法,它们由心脏来源细胞(CDCs)组成,CDCs是一种含有心脏祖细胞的特殊细胞群。它们通过释放包含微RNA、非编码RNA和蛋白的外泌体,改善DMD患者肌肉瘢痕或纤维化以及心脏功能。Deramiocel还显示出有效的免疫调节活性,可能促进细胞再生。新闻稿指出,如果获批,deramiocel将成为治疗DMD心肌病的首款获批疗法。
(6)Corcept Therapeutics小分子新药皮质醇调节剂relacorilant上市申请获受理,有望成为标准治疗
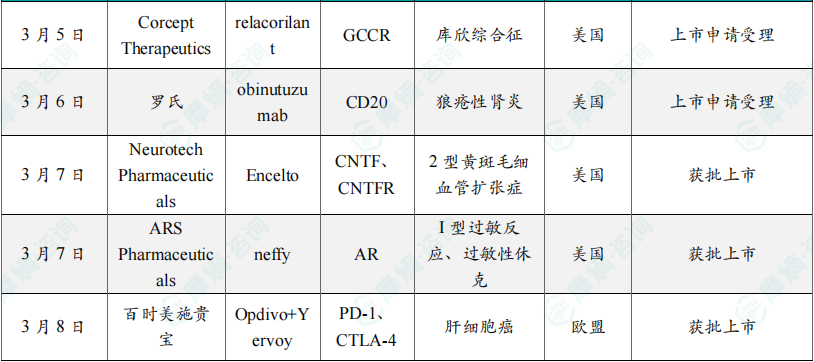
3月5日,Corcept Therapeutics公司日前宣布,美国FDA已接受该公司为选择性皮质醇调节剂relacorilant递交的新药申请,用于治疗内源性高皮质醇症,又名库欣综合征。Relacorilant为一种选择性皮质醇调节剂,可与糖皮质激素受体结合,但不会与体内其他激素受体发生作用。除了治疗内源性高皮质醇症,Corcept还在研究relacorilant在卵巢癌和前列腺癌等多种严重疾病中的应用。Relacorilant已获得美国FDA和欧洲药品管理局授予孤儿药资格,用于治疗库欣综合征。FDA预计在今年12月30日之前完成审评。新闻稿指出,relacorilant有潜力成为库欣综合征的标准治疗。
(7)罗氏突破性疗法CD20单抗obinutuzumab有望获批新适应症,用于治疗狼疮性肾炎
3月6日,罗氏宣布,美国FDA已接受该公司为抗CD20抗体obinutuzumab递交的补充生物制品许可申请,用于治疗狼疮性肾炎。Obinutuzumab是一种抗CD20人源化单克隆抗体,CD20是某些类型B细胞表达的蛋白质。在狼疮性肾炎中,致病B细胞驱动持续性炎症,从而损伤肾脏。通过使用obinutuzumab耗竭致病B细胞,可针对狼疮性肾炎的根本原因,以帮助更好地控制该疾病,保护肾脏免受进一步损伤,并可能预防或延缓疾病进展至终末期肾病。FDA预计在2025年10月前完成审评。新闻稿指出,obinutuzumab是首个在狼疮性肾炎随机3期临床试验中显示出完全肾脏缓解(CRR)益处的抗CD20单克隆抗体。
(8)Neurotech创新疗法Encelto在美国获批上市,针对2型黄斑毛细血管扩张症
3月7日,Neurotech Pharmaceuticals宣布,美国FDA已批准Encelto(revakinagene taroretcel)上市,用于治疗2型黄斑毛细血管扩张症(MacTel)。MacTel是一种罕见的神经退行性疾病,其特征为局部视网膜变性,并伴有视网膜血管的继发性改变。MacTel通常累及双眼,导致中央视力恶化,显著影响患者的生活质量。Encelto是一种眼部植入物,旨在将CNTF以持续的治疗剂量直接递送至视网膜,以延缓疾病进展。2期临床试验结果显示,与未治疗的眼睛相比,接受Encelto治疗的眼睛感光细胞丢失的进展显著降低。新闻稿指出,这是FDA批准治疗MacTel的首个疗法。
(9)ARS Pharmaceuticals吸入式过敏疗法再获FDA批准,针对Ⅰ型过敏反应
3月7日,ARS Pharmaceuticals日前宣布,美国FDA已批准neffy(1 mg肾上腺素鼻喷剂)上市,用于治疗4岁及以上、体重15至30公斤的儿童患者的I型过敏反应,包括可能致命的过敏性休克。neffy(1 mg)是一种单剂量肾上腺素生理盐水鼻喷雾剂,喷入一个鼻孔。与肾上腺素注射产品一样,如果症状没有改善或症状恶化,可以再次喷入新的neffy(在同一鼻孔)。它的2 mg剂型去年8月获得美国FDA的批准,用于治疗成人和至少30公斤儿童患者的I型过敏反应。新闻稿指出,这一批准代表了过去35年来针对该患者群体肾上腺素给药方式的首次重大创新。为受到严重过敏反应困扰的患者和其家庭提供了一种没有针头,不需注射的治疗选择。
(10)百时美施贵宝一线免疫组合疗法在欧盟获批上市,用于治疗肝细胞癌
3月8日,百时美施贵宝宣布,欧盟委员会已批准其重磅PD-1抑制剂Opdivo与CTLA-4靶向抗体Yervoy联用,一线治疗不可切除或晚期肝细胞癌成人患者。Opdivo是一种PD-1免疫检查点抑制剂,旨在帮助恢复抗肿瘤免疫反应,利用人体自身的免疫系统来对抗癌症。Yervoy则靶向抑制CTLA-4。CTLA-4抗体通过增强T细胞活性来提高肿瘤杀伤能力,该产品已于2011年获得美国FDA批准治疗晚期黑色素瘤,是全球首个获批上市的CTLA-4抗体药物。美国FDA已接受Opdivo联合Yervoy治疗同一患者群体的补充生物制品许可申请,预计在今年4月21日之前完成审评。
1.4.2本周全球TOP10积极/失败临床结果

(1)BioNTech/罗氏个体化新抗原疫苗BNT122 1期临床最新数据公布,癌症复发风险降低86%
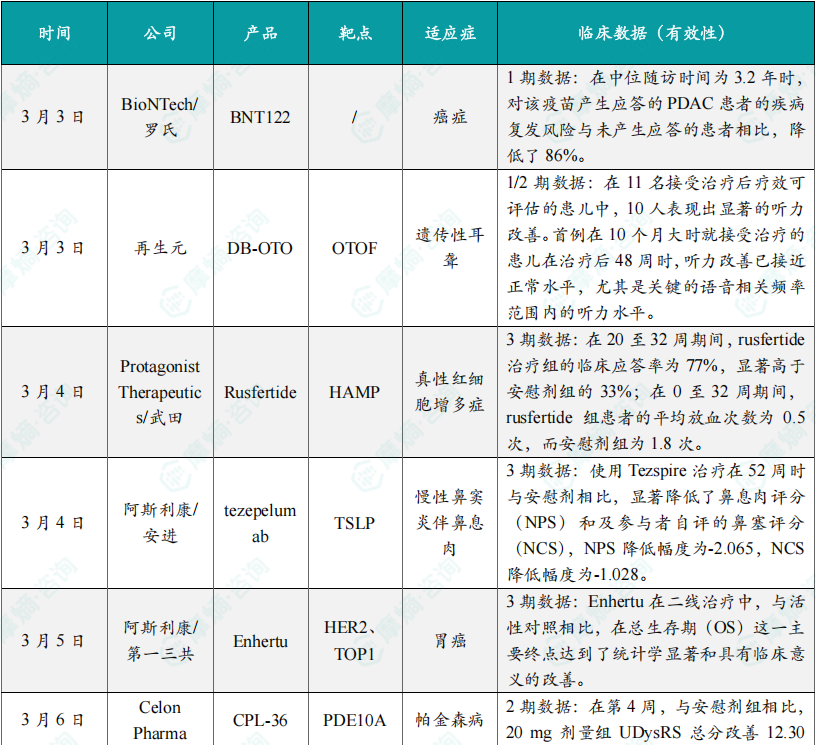
3月3日,纪念斯隆凯特琳癌症中心(MSKCC)科学家领衔的研究团队,在《自然》期刊上发表了由BioNTech和罗氏联合开发的个体化新抗原疫苗autogene cevumeran(BNT122)的1期临床试验最新结果。Autogene cevumeran是基于BioNTech的iNeST癌症疫苗技术平台生成的个体化新抗原疫苗。在2023年发表的研究显示,16名接受癌症疫苗治疗的患者中有8人(50%)产生了T细胞反应,被认为是这种癌症疫苗治疗的应答患者。新公布的论文数据显示,在中位随访时间为3.2年时,对该疫苗产生应答的PDAC患者的疾病复发风险与未产生应答的患者相比,降低了86%。
(2)再生元在研基因疗法DB-OTO 1/2期临床试验新数据公布,针对遗传性耳聋
3月3日,再生元公布了其用于治疗遗传性耳聋的在研基因疗法DB-OTO的1/2期临床试验的新数据。DB-OTO是一种在研细胞选择性腺相关病毒(AAV)基因疗法,旨在通过AAV载体将OTOF基因的健康拷贝传递至耳蜗毛细胞,为因OTOF基因突变导致的先天性深度听力损失患者提供持久的生理性听力。根据试验结果,在11名接受治疗后疗效可评估的患儿中,10人表现出显著的听力改善。首例在10个月大时就接受治疗的患儿在治疗后48周时,听力改善已接近正常水平,尤其是关键的语音相关频率范围内的听力水平。
(3)Protagonist Therapeutics/武田潜在“first-in-class”多肽疗法3期试验积极结果公布
3月4日,Protagonist Therapeutics与武田今天宣布了3期研究VERIFY的初步积极结果,该研究达到主要终点以及所有四个关键次要终点,其潜在“first-in-class”疗法rusfertide作为标准治疗的附加方案,使得近80%真性红细胞增多症患者不再需要接受放血治疗。VERIFY试验是一项进行中、分为三部分的全球性、随机、安慰剂对照3期研究,共纳入293名PV患者,观察期为156周。分析显示,研究达成主要终点。在20至32周期间,rusfertide治疗组的临床应答率为77%,显著高于安慰剂组的33%(p<0.0001),试验主要终点定义为患者无需接受放血治疗。此外,试验亦达成首个关键次要终点,在0至32周期间,rusfertide组患者的平均放血次数为0.5次,而安慰剂组为1.8次。
(4)阿斯利康/安进“first-in-class”疗法Tezspire 3期临床结果公布,两周起效、持续一年
3月4日,阿斯利康和安进日前宣布,其联合开发的Tezspire(tezepelumab)在3期临床试验WAYPOINT中获得的完整结果,已在《新英格兰医学杂志》上发表。数据显示,试验达到了共同主要终点,使用Tezspire治疗在52周时与安慰剂相比,显著降低了鼻息肉评分(NPS)和及参与者自评的鼻塞评分(NCS),NPS降低幅度为-2.065,NCS降低幅度为-1.028,患者在接受治疗第2周就观察到了NCS的改善,并持续至第52周。整体来看,在慢性鼻窦炎伴鼻息肉(CRSwNP)患者中,与安慰剂相比,Tezspire显著降低了鼻息肉严重程度、后续手术需求以及全身性皮质类固醇的使用率。
(5)阿斯利康/第一三共ADC疗法Enhertu 3期临床结果积极,针对胃癌、胃食管交界腺癌
3月5日,阿斯利康和第一三共公司日前宣布,双方联合开发的重磅抗体偶联药物Enhertu(trastuzumab deruxtecan),在3期临床试验DESTINY-Gastric04中获得积极结果。DESTINY-Gastric04是一项全球性、随机、开放标签的3期临床试验,旨在评估在接受含trastuzumab治疗方案后疾病进展的HER2阳性不可切除和/或转移性胃癌或胃食管交界腺癌患者中,Enhertu与抗VEGFR-2抗体ramucirumab及紫杉醇的疗效和安全性。分析显示,在HER2阳性不可切除和/或转移性胃癌或胃食管交界腺癌患者中,Enhertu在二线治疗中,与活性对照相比,在总生存期(OS)这一主要终点达到了统计学显著和具有临床意义的改善。新闻稿表示,Enhertu是首个在随机3期临床试验中,作为二线疗法显著改善HER2阳性胃癌患者总生存期的HER2靶向疗法。
(6)Celon Pharma创新口服帕金森病疗法2期临床结果积极,疗效优异
3月6日,Celon Pharma公司日前宣布,其PDE10A抑制剂CPL-36的2期临床试验取得积极结果。该药为一种每日一次的创新口服药物,用于治疗帕金森病患者中左旋多巴诱导的运动障碍(LID)。该2期临床试验为一项多国、多中心、随机、安慰剂对照试验,在105例伴有LID的帕金森病成年患者中进行。CPL-36以20 mg或40 mg两种剂量每日一次口服给药,并按照1:1:1的比例设置安慰剂对照,治疗期为4周。患者病情基线严重程度为中重度至重度,他们的统一运动障碍评分量表(UDysRS)评分约为45。在第4周,与安慰剂组相比,20 mg剂量组UDysRS总分改善12.30分(p<0.001),而40 mg剂量组改善13.58分(p<0.001)。
(7)ITM Isotope创新多肽偶联药物3期临床达主要终点,预计今年递交新药申请
3月7日,ITM Isotope Technologies公司今日发布了其专有的靶向放射性疗法177Lu-edotreotide,在治疗无法手术切除的进展性1级或2级胃肠胰神经内分泌肿瘤患者的3期临床试验COMPETE中获得的积极结果。试验数据显示,177Lu-edotreotide组的中位PFS为23.9个月,而活性对照组这一数值为14.1个月,此外,与活性对照组相比,177Lu-edotreotide组与研究药物相关的不良事件(TEAE)发生率较低(82.5%比97.0%)。177Lu-edotreotide是一种放射性同位素标记的肽偶联药物,能够将β射线靶向递送至SSTR阳性肿瘤细胞中,同时避免对健康器官和组织的损伤。基于这些积极数据,该公司计划在今年递交新药申请(NDA)。
(8)Tris Pharma潜在“first-in-class”小分子疗法3期临床达主要终点,显著减轻患者疼痛
3月7日,Tris Pharma宣布,在研疗法cebranopadol,在治疗拇囊炎切除术后中度至重度急性疼痛的关键性3期临床试验ALLEVIATE-2中达到主要临床终点,与安慰剂相比显著减轻患者疼痛。试验数据显示,每日口服cebranopadol(400 µg)治疗组与安慰剂组相比,疼痛强度的最小二乘均值差为56.1。此前,cebranopadol在治疗腹壁整形手术后中度至重度急性疼痛的3期临床试验ALLEVIATE-1中也达到试验主要终点。基于这些积极结果,该公司计划今年向美国FDA递交新药申请。
(9)阿斯利康重磅免疫疗法达3期临床主要终点,无事件生存期显著改善
3月8日,阿斯利康公司宣布,3期临床试验MATTERHORN获得积极顶线结果,其重磅PD-L1抑制剂Imfinzi(durvalumab)与标准治疗FLOT(fluorouracil、leucovorin、oxaliplatin和docetaxel)联用的围手术期治疗方案,在无事件生存期(EFS)这一主要终点上表现出统计学显著且具有临床意义的改善。Imfinzi是一种人源化的单克隆抗体。通过与PD-L1的结合,阻断PD-L1与PD-1和CD80蛋白的结合,进而抑制肿瘤的免疫逃逸机制。在此前报告的关键性次要终点病理学完全缓解率(pCR)的中期分析中,Imfinzi组合治疗方案的pCR率与单纯新辅助化疗相比,提高两倍以上。
(10)诺华siRNA降胆固醇药物英克司兰钠3期临床数据公布,近80%患者降脂达标
3月9日,诺华siRNA降胆固醇药物乐可为(英克司兰钠注射液,inclisiran)的亚洲3期临床研究ORION-18的结果于近期发表在《中国循环杂志》上。研究结果显示,中国患者亚组分析结果与亚洲总体人群中的分析结果一致。在已接受饮食控制和最大耐受剂量他汀类药物治疗(联合或不联合其他降脂治疗)但LDL-C仍升高的中国动脉粥样硬化性心血管疾病(ASCVD)患者或ASCVD高危者中,英克司兰钠组LDL-C从基线至第330天经安慰剂校正的百分比降幅为61.16%,在亚洲总体人群中降幅为57.17%。该研究还显示,英克司兰钠治疗可显著提高LDL-C达标率,第330天时,英克司兰钠组的LDL-C<1.8 mmol/L达标率为79.6%,而安慰剂组仅为7.8%。
同期事件:
1. 2025年第10周03.03-03.09国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第10周03.03-03.09国内仿制药/生物类似物申报/审批数据分析
3. 2025年第10周03.03-03.09国内医药大健康行业政策法规汇总
以上内容均来自{摩熵咨询医药行业观察周报(2025.03.03-2025.03.09)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论