
据《药融云医药行业观察周报》数据统计,在2022.11.28-2022.12.04期间,共计有17款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药9款,生物药8款。在获批临床的创新药/改良型新药中,有几个值得关注的新药。
获批临床创新药/改良型新药信息速览(部分)
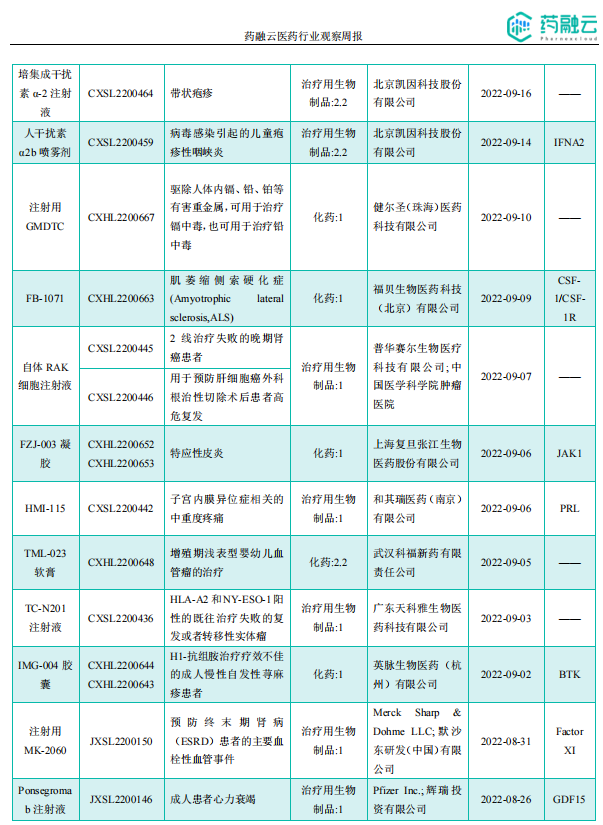
图片来源:《药融云医药行业观察周报》
(1)注射用MK-2060——FXI/FXIa双重抑制剂
注射用MK-2060是默沙东在研的一种具有抑制凝血因子XI和Xia新型双重活性的单克隆抗体,既能阻断凝血因子XI的活化,又能阻断活化蛋白的下游活性,是目前针对终末期肾病(ESRD)开发的唯一一款双FXI/FXIa抑制剂。
注射用MK-2060的审评时间轴
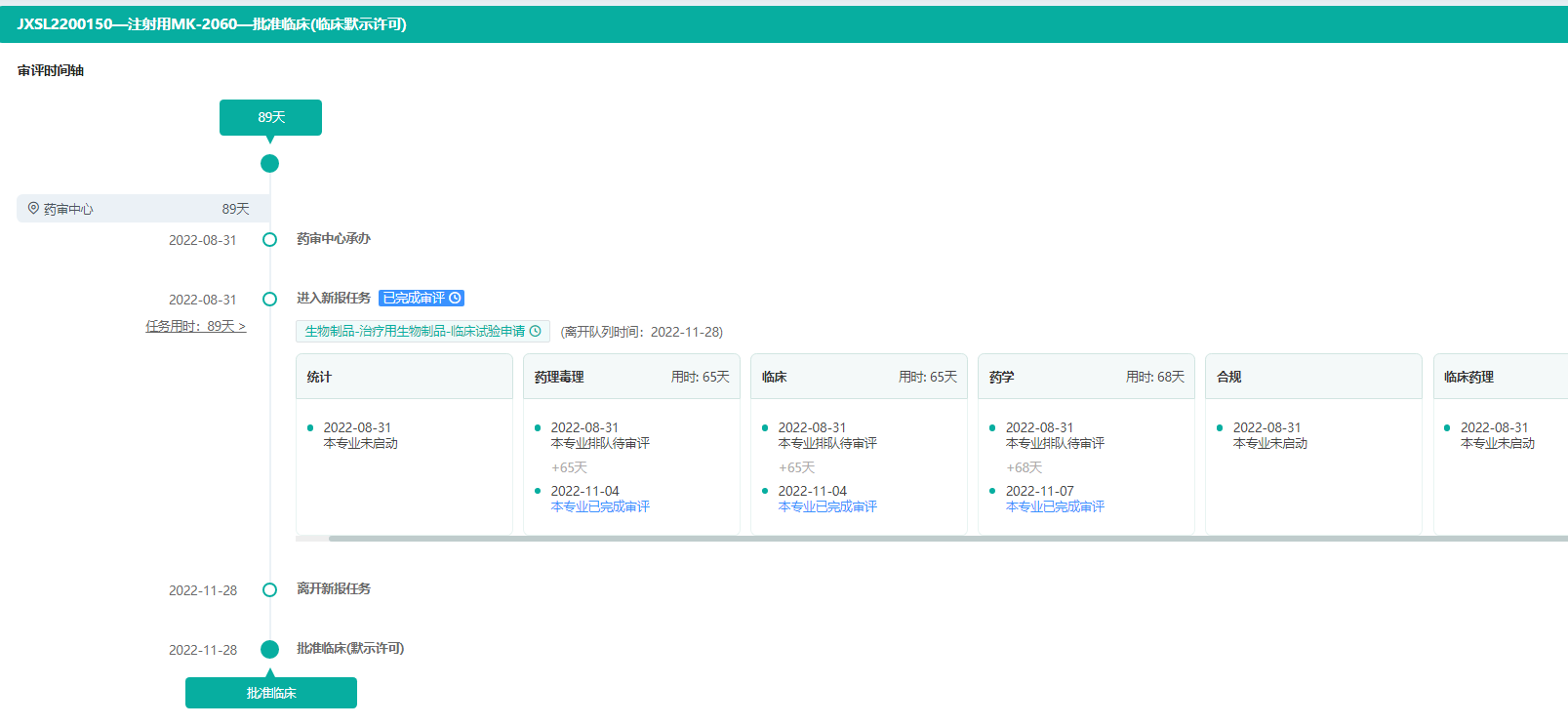
图片来源:药融云中国药品审评数据库
据药融云全球药物研发数据库显示,2022年8月默沙东获得了FDA对MK-2060的快速通道指定,这是一种用于降低终末期肾病患者主要血栓性心血管事件风险的研究性抗凝剂疗法。ESRD患者的血栓和出血风险均较高,迫切需要更好的抗凝药物供临床选择。MK-2060现正在美国开展治疗终末期肾病的II期临床试验。
MK-2060研发状态及特殊审评
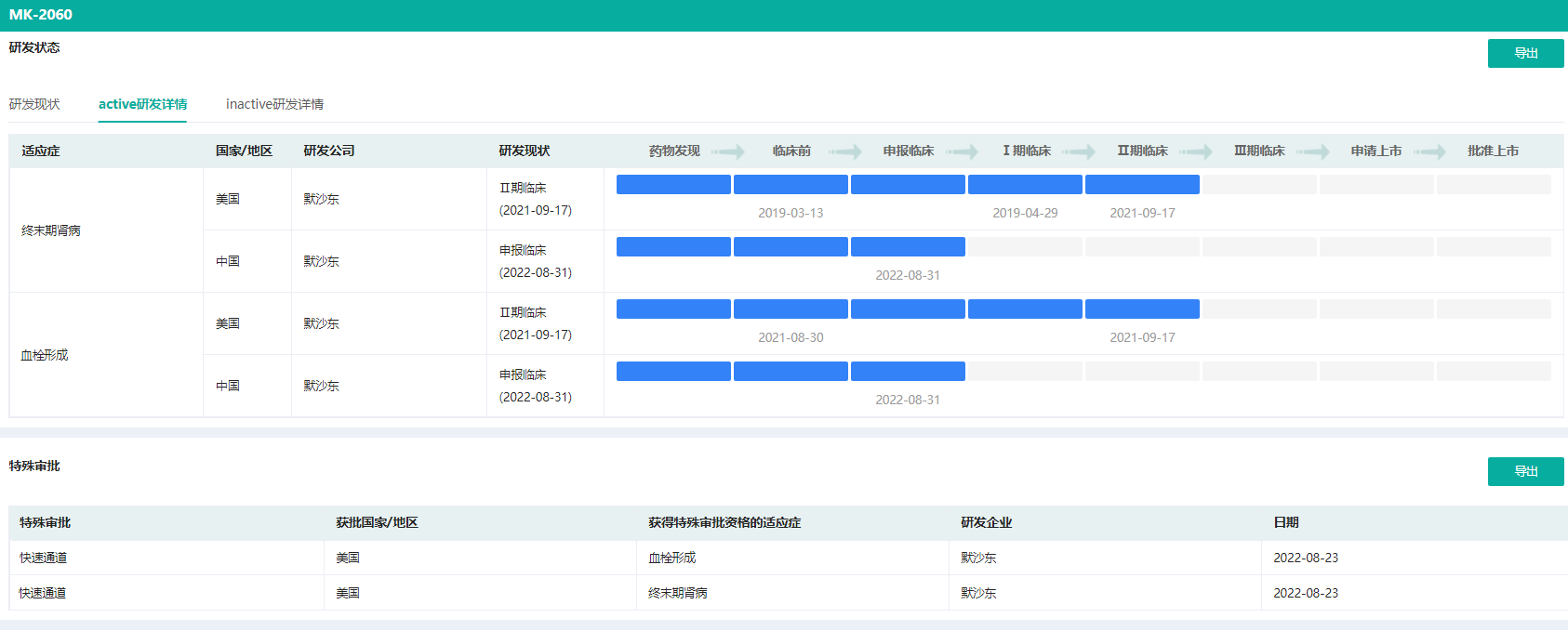
图片来源:药融云全球药物研发数据库
(2)Ponsegromab注射液——国内首个获得临床批准的GDF15单抗
Ponsegromab注射液是辉瑞研发的一款1类生物制品,拟用于治疗癌症相关恶液质和成人患者心力衰竭。Ponsegromab注射液通过阻断大脑中GDF15与GFRAL受体结合,从而改善癌症和心衰等疾病导致的食欲丧失、体重减轻等症状,也是国内首个获得临床批准的GDF15单抗。
Ponsegromab全球临床试验适应症分布
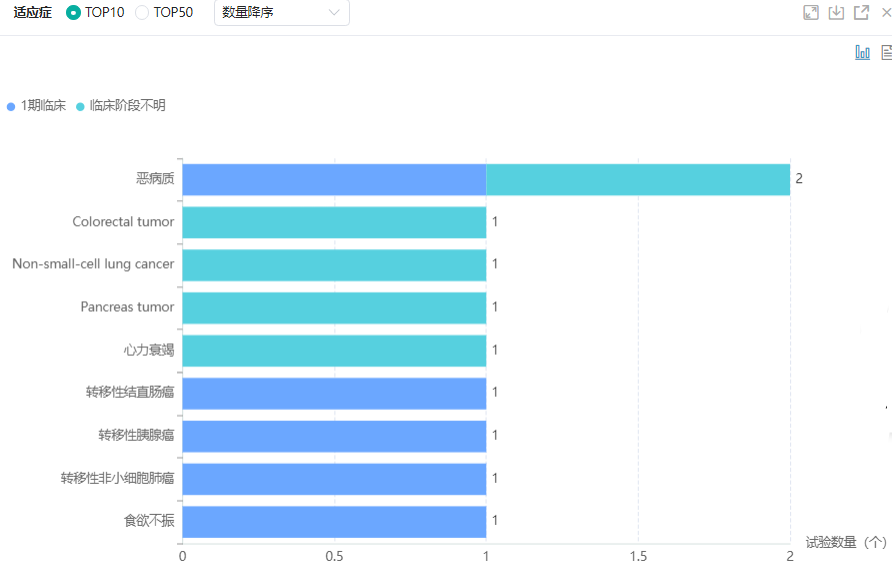
图片来源:药融云全球临床试验数据库
据药融云靶点格局数据库统计,目前全球暂无靶向GDF15(生长分化因子15)的新药上市,其中处于II期临床阶段的有2款,I期临床6款,临床前2款,处于药物发现阶段的有20款。而针对GDF15靶点的开发,布局企业除辉瑞外,还包括安进、强生、阿斯利康,诺和诺德、礼来制药等企业。
全球GDF15靶点药物研发阶段分布
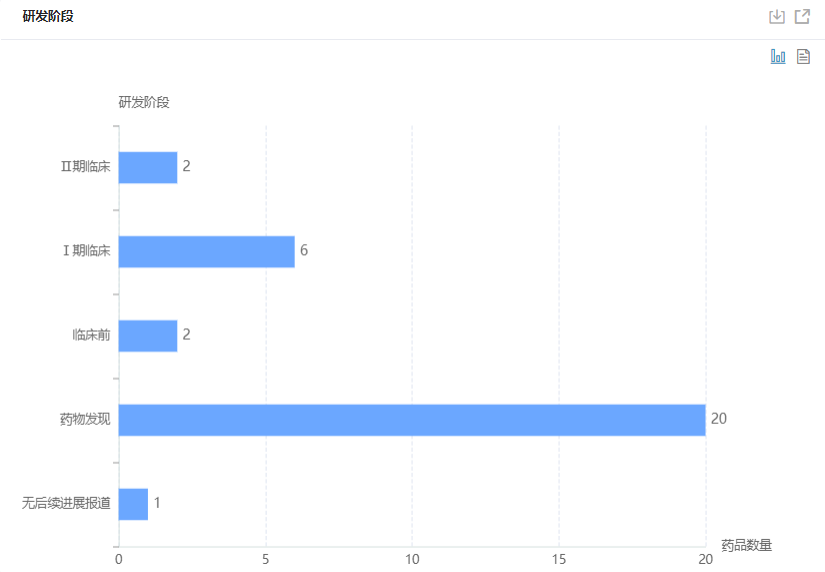
图片来源:药融云靶点格局数据库
通过全球同靶点适应症分析维度,还可以看到全球布局GDF15靶点的药物适应症分布及占比。生长分化因子15(GDF15)为一种内分泌激素,是TGFβ超家族成员,与大脑中的GFRAL受体结合,可导致机体食物摄入减少、体重减轻等,在肥胖、癌症、恶病质、糖尿病、心血管疾病、胰腺肿瘤、厌食症等疾病的发病机制中扮演重要角色。
GDF15靶点适应症分析
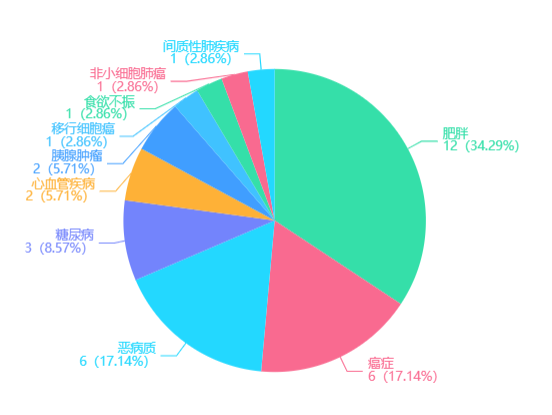
图片来源:药融云靶点格局数据库
癌症相关厌食/恶病质综合征( CACS)是指癌症患者在患病过程中不可控制的体重减轻,其症状包括厌食,肌肉量和脂肪组织减少引起的体重减轻。每年全球癌症死亡人数的一半(约820万人)归因于最常与恶病质相关的癌症,如胰腺癌(33万人死亡),食道癌(40万),胃癌(72万),肺癌(159万),肝癌(75万)和结肠直肠癌(69万)。目前针对癌症恶病质的治疗剂仅针对增加食欲,对于解决包括肌肉质量减少和能量代谢改变等一系列问题的治疗方法仍是空白。
(3)FB-1071——治疗肌萎缩侧索硬化症
FB-1071是福贝生物研发的一款具有全新分子结构的针对CSF1R靶点的小分子药物,通过特异性地抑制CSF1R,调节中枢小胶质细胞和外周巨噬细胞,从而抑制神经炎症及其引起的神经损伤,减缓病程发展,帮助神经细胞修复,拟开发用于治疗肌萎缩侧索硬化症(俗称渐冻症,简称ALS)。
FB-1071不同适应症研发详情(部分)
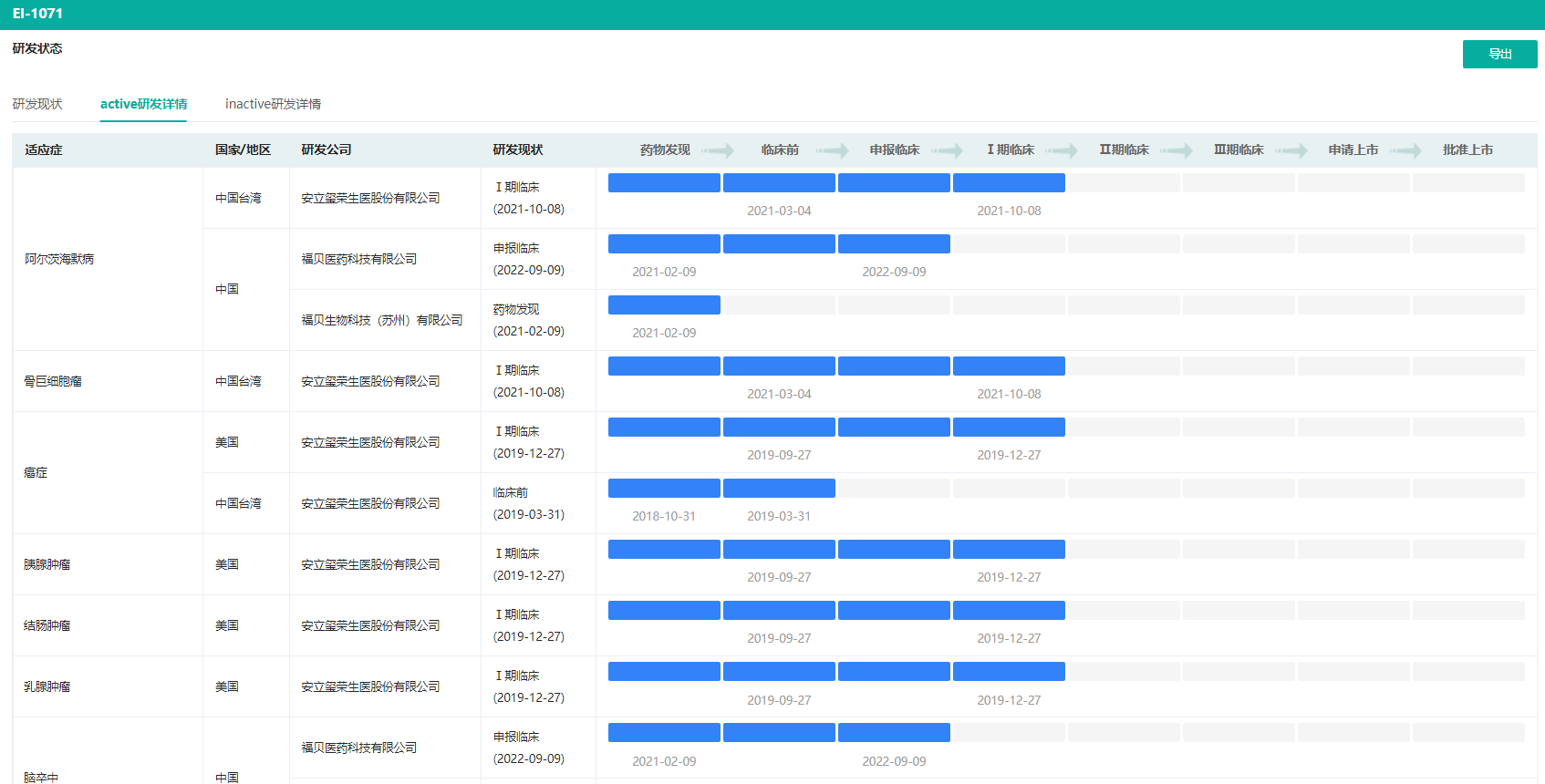
图片来源:药融云全球药物研发数据库
渐冻症也叫运动神经元疾病,是一种罕见的累及上运动神经元(大脑、脑干、脊髓),又影响到下运动神经元(颅神经核、脊髓前角细胞)的神经退行性疾病,在中国俗称"渐冻人症",可导致肌无力、残疾和最终死亡,中位生存期为3-5年。渐冻症最可怕的一面,并不是疾病本身,而是在病情恶化过程中,大脑功能不受丝毫影响,病人不得不清醒体验身体瘫痪的全过程。
除了症状治疗外,ALS仍无药物治疗可有效改变病程。受累者的疾病进展速度差异很大,临床特征包括各种运动系统和非运动系统体征和症状。因此,延迟诊断很常见。目前已有缓解症状的药物,还有两种特别的药物,利鲁唑和依达拉奉,能带来数月的生存获益。
赛诺菲的利鲁唑(Riluzole,Rilutek)是第一个获美国FDA和欧盟批准用于治疗ALS的药物,也是目前唯一公认对缓解ALS进展有效的药物,可改善病人生存状态,推迟ALS患者发生呼吸功能障碍时间,延长存活期,但却无法阻止ALS病情的发展。
据药融云全国医院销售数据库显示,2021年利鲁唑在医院端的销售规模达到6972.32万元,同比增长21.14%;其中原研企业赛诺菲占据75.23%的市场份额,江苏恩华药业占据14.49%,鲁南贝特制药占9.05%。
利鲁唑医院端的年度销售趋势
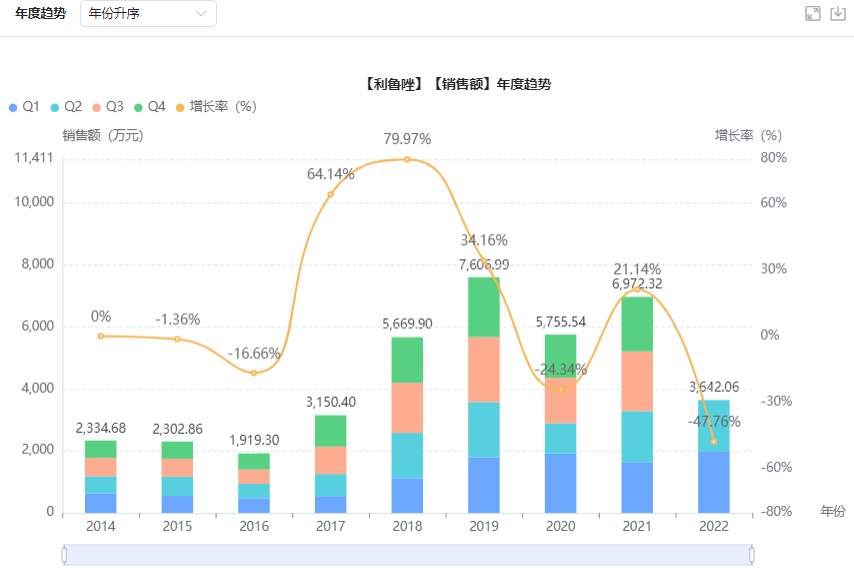
图片来源:药融云全国医院销售数据库
依达拉奉(Edaravone,Radicava)是一种脑保护剂(自由基清除剂),为期6个月的临床试验证明依达拉奉能够减缓ALS相关的日常功能衰退,基于这一研究,FDA于2017年批准其用于治疗ALS。
药融云全球药物研发数据库显示,日本三菱制药公司研发的依达拉奉于2001年4月在日本上市,2017年5月美国FDA批准了田边三菱的依达拉奉用于治疗肌萎缩侧索硬化症(即渐冻人症),2019年7月在中国获批上市。
依达拉奉是在众多的神经保护剂中极少具有作用机制明确、具有多项循证医学证据、经过多年使用疗效和安全性得到临床肯定的药品。因此,依达拉奉在国内上市十几年来逐步成为国内卒中急性期治疗的一线药物。
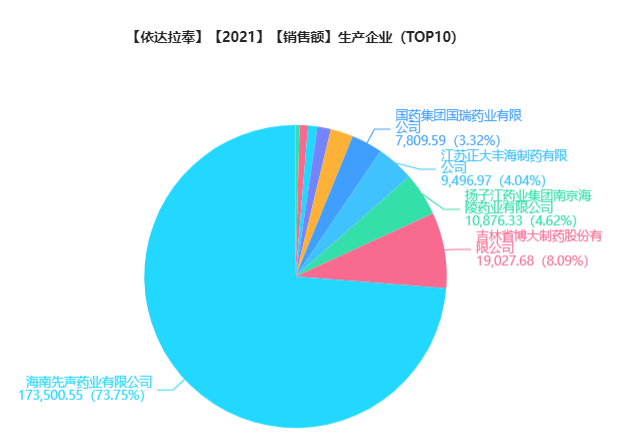
图片来源:药融云全国医院销售(全终端)数据库
据药融云数据库统计,依达拉奉在全国医院销售(全终端)的销售额曾高达55.48亿元。先声药业、吉林博大、国药国瑞、扬子江等企业先后仿制。2021年,先声药业的依达拉奉医院全终端的销售额高达17.36亿元,以73.75%的市场份额在中国依达拉奉市场排名第一。
药融云数据库显示,依达拉奉通过/视同通过一致性评价的企业还有正大丰海制药、博大制药、天泉药业、扬子江药业集团上海海尼药业、国药集团国瑞药业、积大制药、正大丰海制药、齐鲁制药等。
想要解锁更多新药研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论