1.1 背景及药物简介
伊布替尼属于第一代BTK抑制剂药物,由强生和艾伯维共同研发,是全球首个上市的BTK抑制剂;泽布替尼属于第二代药物,由百济神州自主研发,也是我国首个成功在美国上市的国产抗癌药。
伊布替尼VS泽布替尼
截图来源:药融云全球药物研发数据库
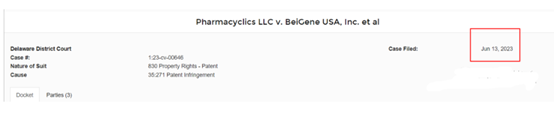
消息:2023年6月,艾伯维公司称百济神州的泽布替尼侵犯伊布替尼的专利,将在美国地方法院提起诉讼(美国特拉华州地方法院提起诉讼)。这是艾伯维针对Brukinsa提起的第一起专利侵权诉讼。
百济神州对此回应:“我们将在适当的时候对该诉讼作出应对,并开展积极的辩护”。
涉及专利:US11672803(用途专利),地域:美国
1.2 US1672803专利信息

注:艾伯维旗下公司Pharmacyclics LLC公司
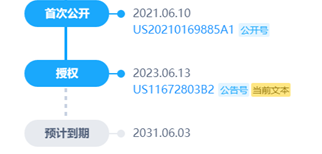
有一个非常有趣的点,为什么申请日是2011.06.03,而该公开日却在2021.06.10,中间发生了什么。
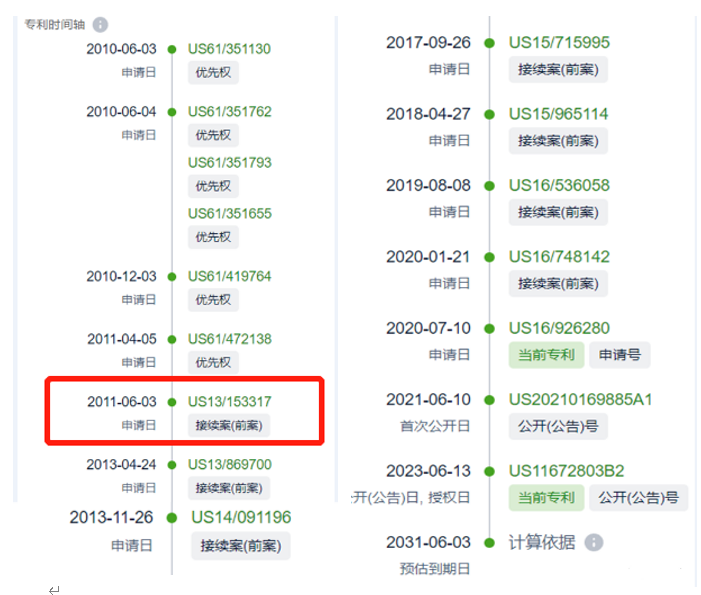
可以看出,有趣的是,2010年的最早优先权,2021年首次公开,2023年6月13日专利授权。然后艾伯维起诉百济神州专利侵权的日子,恰巧也是2023年6月13日(当然,也可以解释为,授权才有资格谈论侵权,但是隐藏了11年之久,值得深思)。
注:美国专利存在一种“潜水艇专利”,即专利申请人利用连续案申请策略,在放弃母案前另提子案、放弃子案前另提孙案之类的操作,争取更大的保护范围,并利用申请保密规定,等到竞争对手的产品及市场发展成熟,才让依根据竞争对手产品量身打造的专利申请授权公告,像潜水艇一样浮出水面伏击对手。
1.2.1独立权利要求-原文(1和8)
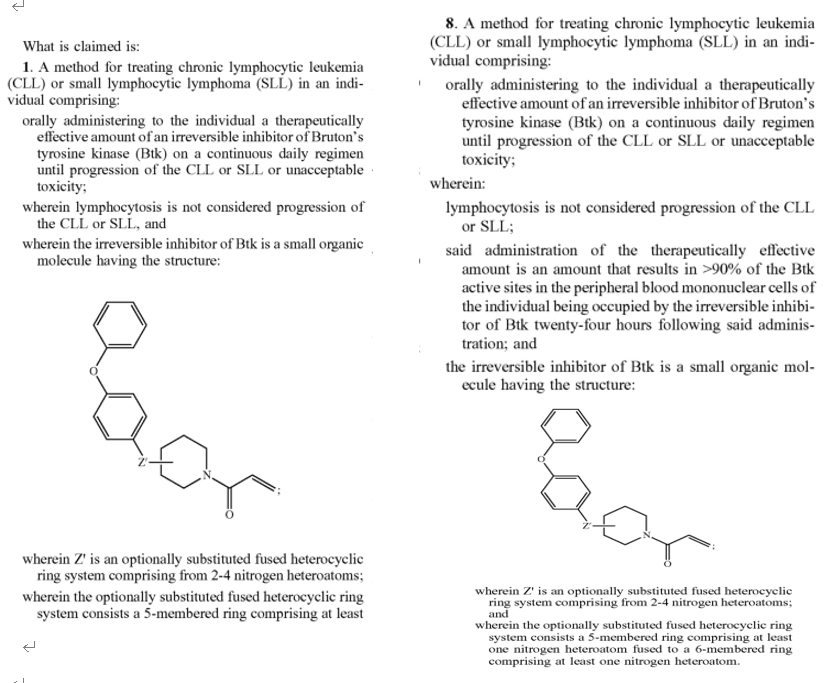
1.2.2独立权利要求-中文译文(1和8)
1、一种用于治疗需要的个体的慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的方法,包括以连续的每日方案向个体口服治疗有效量的不可逆的Btk抑制剂的量,直到CLL或SLL进展或不可接受的毒性;
其中淋巴细胞增多不被认为是CLL或SLL的进展,以及其中Btk的不可逆抑制剂是具有以下结构的有机小分子:
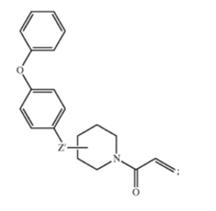
其中Z'是由2~4个氮杂原子组成的可选择性取代的稠杂环体系;
其中,可选择性取代的稠杂环体系由至少包含一个5元环组成
8、一种用于治疗需要的个体的慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SL)的方法,包括以连续的每日方案向个体口服治疗有效量的不可逆的Btk抑制剂的量,直到CLL或SLL进展或不可接受的毒性;
其中淋巴细胞增多不被认为是CLL或SLL的进展,
所述的治疗有效剂量是指在治疗24小时后,使个人外周血单个核细胞中90%以上的btk活性位点被btk的不可逆抑制因子所占据;
其中Z'是由2~4个氮杂原子组成的可选择性取代的稠杂环体系;
其中,可选择性取代的稠杂环体系是由至少一个氮杂原子组成的五元环和由1个氮杂原子组成的六元环融合而成。
1.3 泽布替尼,美国注册信息
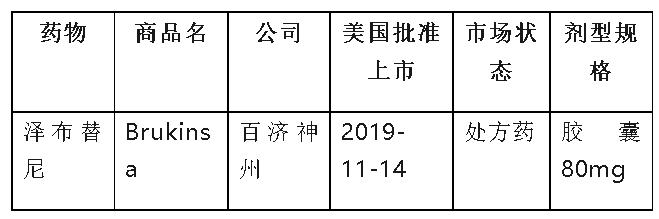
1.3.1美国批准适应症:
第一项适应症:BRUKINSA是一种激酶抑制剂,适用于治疗已接受至少一种先期治疗的成年患有套细胞淋巴瘤(MCL)的患者。该指示根据总响应率在加速批准下得到批准。对该适应症的持续批准可能取决于验证试验中的临床益处的验证和描述。
第二项适应症:批准用于治疗成年华氏巨球蛋白血症(WM)患者。
第三项适应症:批准治疗既往至少接受过一种包含抗CD20治疗的边缘区淋巴瘤(MZL)成人患者。
l第四项适应症:批准用于治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)成人患者(2023年1月20日批准)

1.3.2给药方式
建议剂量:每天两次160毫克口服或每天一次320毫克口服;用水或食物一起吞咽整只。
减少严重肝功能不全患者的BRUKINSA剂量。
建议患者不要打开,破坏或咀嚼胶囊。
通过中断治疗,减少剂量或中止治疗毒性。
剂量形式和强度
胶囊:80mg
1.4 泽布替尼是否侵权
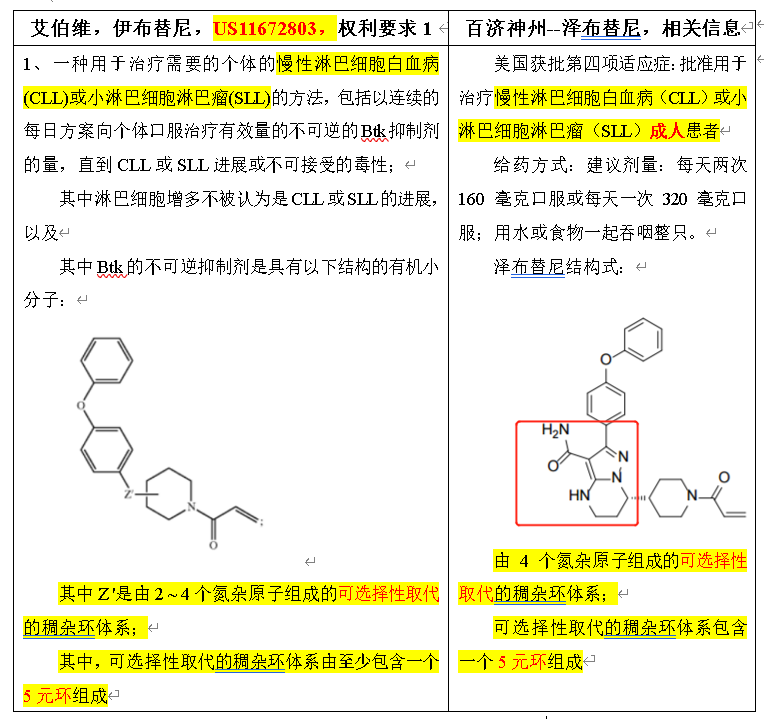
注:稠杂环化合物,是指苯环与杂环稠合或杂环与杂环稠合在一起的化合物
那么,我们对泽布替尼和伊布替尼的US11672803要求保护的技术方案进行逐一分析:
首次,泽布替尼在美国批准的适应症是慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)成人患者,落在权利要求1所述的一种用于治疗需要的个体的慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)的方法的保护范围。
其次,泽布替尼的给药方式,建议剂量:每天两次160毫克口服或每天一次320毫克口服;用水或食物一起吞咽整只,而权利要求1是保护:包括以连续的每日方案向个体口服治疗有效量的不可逆的Btk抑制剂的量,直到CLL或SLL进展或不可接受的毒性;
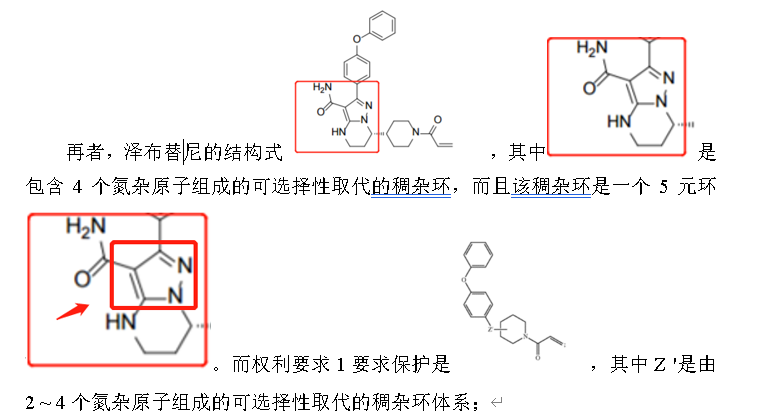
其中,可选择性取代的稠杂环体系由至少包含一个5元环组成,由此可见,泽布替尼的结构式落入在权利要求1的结构式之中。
由此可见,在目前对技术方案的逐一对比之后,泽布替尼是落在伊布替尼的US11672803所要求保护的技术方案之内的。故此,百济神州可以探索的方案,现有技术的抗辩或者是进行专利无效的考虑。
1.5 如果判定侵权,赔偿依据
1.5.1赔偿法律依据
《专利法》对赔偿的计算方式作了原则性的规定,《规定》细化了各种计算方法,并且增加了一种计算方法———法定赔偿。赔偿的计算方式有四种:
1.根据侵权人因侵权获得的利益计算
2.根据被侵权人因为侵权而受到的损失计算
3.根据专利许可费的倍数确定赔偿数额
4.法定赔偿
没有专利许可使用费可以参照或者专利许可使用费明显不合理的,人民法院可以根据专利权的类型、侵权行为的性质和情节等因素,依照专利法第六十五条第二款的规定确定赔偿数额。
对故意侵犯专利权,情节严重的,可以在按照因侵权造成的损失确定数额的1倍以上5倍以下确定赔偿数额;
侵犯专利权的法定赔偿数额为3万元以上500万元以下;
赔偿数额应当包括权利人为制止侵权行为所支付的合理开支。
1.5.2泽布替尼部分销售数据
2022年,数据显示泽布替尼全球销售额达38.29亿元,在美国销售额为26.44亿元。目前,泽布替尼在美国市场的收入已占其全球销售额近七成。
2023年第一季度,百悦泽的销售额比2022年的最后三个月猛增了约20%,达到2.11亿美元。SVB证券公司的分析师认为百悦泽在美国和欧盟,仅在CLL/SLL适应症的销售额峰值就将达到31亿美元。
1.6 后记
面对艾伯维的来势汹汹,百济神州将会对该诉讼作出应对,并开展积极的辩护。值得注意的是,相关适应症是泽布替尼在美国获批的第四项适应症:慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)成人患者,而且这是在2023年1月20日批准的,使用该适应症为泽布替尼在美国贡献了多少的销售额,是在侵权考虑的范围内的。
专利战一触而发,我们等候法院的诉讼结果。
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论