本周医药资讯一览
:3款药物纳入拟优先审评品种公示;6款药物纳入拟突破性治疗品种公示;中国研发新冠治疗性抗体新药在欧美获批紧急使用;石药集团获抗IL-4Rα单抗CM310中国区独家权;以岭药业2021Q1净利润有望超7亿;复宏汉霖CD73抗体启动临床;诺和诺德一周一次长效胰岛素在中国启动临床;国家卫健委发布第二批鼓励仿制药品目录;十省(区、兵团)联盟带量采购头孢氨苄……
一、
医药政策简报
国家卫健委发布第二批鼓励仿制药品目录
3月15日,国家卫健委联合科技部、工业和信息化部、国家医保局、国家药监局、国家知识产权局等部门组织专家对国内专利即将到期尚未提出注册申请及临床供应短缺(竞争不充分)的药品进行遴选论证,并制定了《第二批鼓励仿制药品目录》进行发布。其中包含了米拉贝隆、奥贝胆酸等在内的17个品种。(国家卫健委)

延伸阅读:
此前2019年9月17日,发布第一批鼓励仿制药品目录,共33个品规,2批合计50个!CDE也发布了3批临床急需临床境外新药名单(第一批40个,第二批26个,第三批7个)。
十省(区、兵团)联盟带量采购头孢氨苄
3月19日, 广东省药品交易中心发布公开征求《头孢氨苄药品联盟地区集团带量采购文件(征求意见稿)》意见的通知,《意见稿》明确广东、宁夏、河南、青海、新疆、新疆兵团、云南、广西、贵州、海南将联合带量采购头孢氨苄。本次集团带量采购的药品是头孢氨苄,包含口服常释剂型、口服液体剂、颗粒剂、泡腾片、缓释控释剂型。头孢氨苄通用名下所有规格均被纳入此次广东联盟。本次头孢氨苄药品联盟带量采购周期至2023年6月30日,自中选结果实际执行日起计算。(广东省药品交易中心)
江苏省药监局发布百时美施贵宝注销药品经营许可证通知
3月15日,江苏省药监局发公告称,根据《行政许可法》、《药品管理法》、《药品经营许可证管理办法》等相关规定,经百时美施贵宝(中国)医药有限公司书面申请,决定注销百时美施贵宝(中国)医药有限公司的《药品经营许可证》,许可证证号为:苏AA5100400。(江苏省药监局)
四川省药监局发布暂停经营使用广西凌云县制药复方金银花颗粒通知
3月17日,四川省药监局称近日该局收到来自广西壮族自治区药品监督管理局发出的《关于协助召回广西凌云县制药有限责任公司复方金银花颗粒的函》,请求对其辖区内生产企业广西凌云县制药有限责任公司生产的品种复方金银花颗粒进行下架并协助召回。(四川省药监局)
国家药监局发布关于修订阿魏酸钠注射制剂、氟哌啶醇制剂说明书公告
3月18日,国家药监局发布关于修订阿魏酸钠注射制剂和氟哌啶醇制剂说明书的公告,决定分别对两种药物说明书中的【不良反应】、【禁忌】、【注意事项】、【药物相互作用】、【药物过量】等项做出统一修订。(国家药监局)
二、医药研发速递
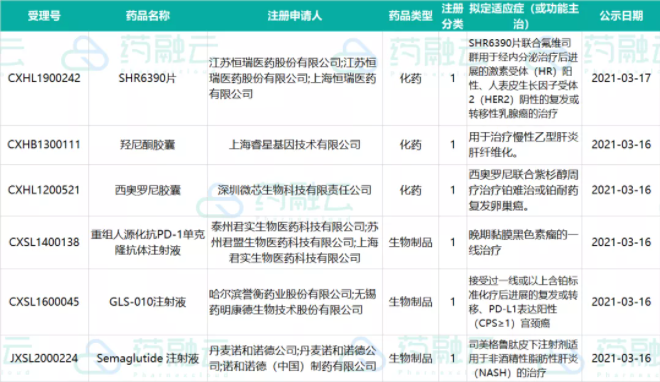
3款药物纳入拟优先审评品种公示
本周3款药物纳入拟优先审评品种公示,涉及百济神州、辉瑞以及凯茂生物。
CDE纳入拟优先审评品种

划重点:百济神州的【注射用贝林妥欧单抗】和辉瑞的【阿布昔替尼片】是按优先审评范围“(二)符合儿童生理特征的儿童用药品新品种、剂型和规格”纳入优先审评审批程序。
6款药物纳入拟突破性治疗品种公示
本周6款药物纳入拟突破性治疗品种公示,涉及恒瑞、君实、微芯、诺和诺德、药明康德等。
CDE纳入拟突破性治疗
首款FDA批准心包炎疗法!IL-1抑制剂有望改变治疗范式
3月19日,Kiniksa Pharmaceuticals宣布,美国FDA已批准该公司开发的IL-1抑制剂Arcalyst(rilonacept)上市,用于治疗12岁以上复发性心包炎(recurrent pericarditis)患者和减轻心包炎的复发风险。新闻稿指出,这是首款获得FDA批准的复发性心包炎疗法。(药明康德)
诺和诺德一周一次长效胰岛素在中国启动临床
中国药物临床试验登记与信息公示平台最新公示,诺和诺德在中国启动一项研究icodec胰岛素在中国2型糖尿病受试者中药代动力学特征的试验,旨在评估icodec胰岛素注射给药后在患者血液中随时间变化的停留和变化情况。根据公开资料,icodec胰岛素是一种在研长效基础胰岛素类似物,半衰期约一周。(医药观澜)
延伸阅读:2020年11月27日, 中国国家药监局药品审评中心(CDE)公示诺和诺德(Novo Nordisk)的周胰岛素制剂icodec胰岛素注射液在中国获批临床。据药融云数据全球药物研发数据库查询,目前icodec胰岛全球研发最高阶段为临床Ⅲ期。

数据来源:药融云全球药物研发数据库
吉利德与默沙东联手开发长效HIV组合疗法
3月16日,吉利德科学和默沙东联合宣布,双方已经达成协议,共同开发和推广长效HIV组合疗法。这一组合包括吉利德公司的衣壳抑制剂lenacapavir和默沙东公司的创新核苷逆转录酶易位抑制剂islatravir。这两款创新疗法均为潜在“first-in-class”药物,并且都处于后期临床开发阶段。它们的组合有望为HIV患者提供完整的口服或注射型长效治疗方案。(药明康德)
复宏汉霖CD73抗体启动临床
据了解,3月15日,复宏汉霖在Clinical.gov网站登记了CD73抗体HLX23的美国一期临床,用于治疗实体瘤。这是继天境生物、中山康方之后第3家进入临床的CD73抗体。(医药笔记)
中国研发新冠治疗性抗体新药在欧美获批紧急使用
3月15日,从中国科学院微生物研究所获悉,欧洲药品管理局人类用医药产品委员会近日允许欧盟成员国,在公共卫生紧急情况下使用单克隆抗体LY-CoV555与LY-CoV016的联合疗法(“抗体鸡尾酒”疗法)应对新冠肺炎感染患者。(财联社)
三、医药行业信息
首药控股科创板IPO获受理
3月16日,上海证券交易所披露受理首药控股科创板IPO申报材料。首药控股计划本次公开发行股票数量不超过3178万股,初步计划在科创板募集资金20亿元,中信建投证券为保荐机构和主承销商。
延伸阅读:首药控股于2016年4月在北京经济技术开发区注册成立,是一家研发、生产肿瘤和糖尿病一类新药的企业。目前已申请国家发明专利120项,取得授权36项,获得国家一类新药临床批件16个。2019年3月,双鹭药业在首药控股Pre-A轮融资阶段投资5000万元;2019年7月,首药控股完成2亿元A轮融资,由亦庄国投独家投资。2020年9月,首药控股完成了6500万元Pre-IPO融资,由中信建投和领承创投投资,投后估值为50.65亿元。

来源:首药控股官网
石药集团获抗IL-4Rα单抗CM310中国区独家权
10日,石药集团发公告称,其全资附属公司津曼特生物已与康诺亚生物订立协议。根据协议,津曼特生物将获得康诺亚生物一款抗IL-4Rα单抗CM310在中国大陆地区的独家开发和商业化权利,以用于治疗中重度哮喘、慢性阻塞性肺病等呼吸系统疾病。(石药集团公告)
仙琚药业拟与清华大学等设立参股公司
3月19日,仙琚制药发布公告称,为有效承接外部研发资源,适当布局诊断检测领域。公司拟出资1,960.73万元与清华大学、全芯集力(宁波)生物技术合伙企业(有限合伙)共同投资设立“杭州梓晶生物科技有限公司”。(新浪医药新闻)
以岭药业2021Q1净利润有望超7亿
以岭药业近日发布2021年第一季度业绩预告,报告期内归属于上市公司股东的净利润65,696.24万元—70,075.99万元,比上年同期增长50%—60%;基本每股收益0.55元/股—0.59元/股。(以岭药业公告)
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论