恒瑞海外引进眼科新药
2019年11月7日,恒瑞医药(600276.SH)发布引进德国Novaliq公司产品的公告。恒瑞医药与德国Novaliq公司达成协议,引进德国Novaliq公司用于治疗干眼症(Dry eye disease,DED)的药物:CyclASol®(0.1%环孢素A制剂)和NOV03(全氟己基辛烷),恒瑞获得这两个产品在中国的临床开发、生产和市场销售的独家权利。
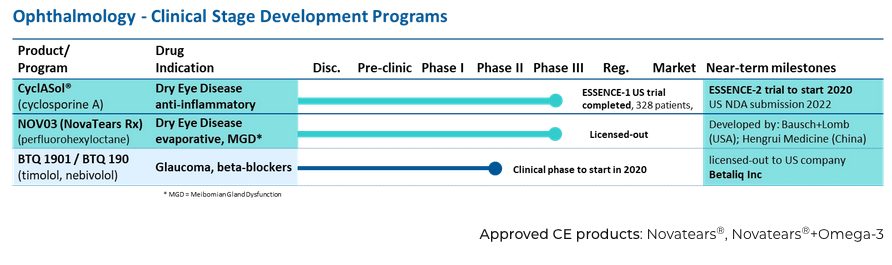
这两款药物是德国Novaliq公司基于全球首个无水药物递送技术平台EyeSol™®开发的药物,主要用于针对性治疗两种不同类别的干眼症。CyclASol®(0.1%环孢素A制剂)是一种抗炎和免疫调节剂,用于治疗水液缺乏型干眼症,目前正在美国进行III期临床试验。NOV03(全氟己基辛烷)用于治疗与睑板腺功能障碍(MGD)相关蒸发过强型干眼症。
根据流行病学研究《干眼临床诊疗专家共识2013年》,中国干眼症发病率大约在21%-30%,其中MGD相关蒸发过强型干眼症患者占大部分比例。目前国内最常用的治疗方案为人工泪液和激素,对于中重度干眼症,大多数患者未能获得满意的治疗结果。
药融云数据显示的双方合作协议主要条款
一、 许可范围
恒瑞获得 CyclASol™和 NOV03 在许可区域,即中华人民共和国(包括中国 大陆、香港、澳门和台湾)的临床开发、生产和市场销售的独家权益。CyclASol™许可的适应症为所有人类或动物类眼科疾病,包括但不限于干眼症;NOV03许可的适应症为人类或动物类干眼症。本项许可不涉及商标许可。
二、 研发及上市里程碑付款
从 CyclASol™在中国的第一项注册临床研究开始至第一个适应症在中国获 批上市,恒瑞将按研发进展向 Novaliq 公司支付累计不超过 500 万美元的里程碑款。 从 NOV03 在中国的第一项注册临床研究开始至第一个适应症在中国获批上市,恒瑞将按研发进展向 Novaliq 公司支付累计不超过 700 万美元的里程碑款。
三、 销售里程碑付款
从 CyclASol™在中国启动商业销售开始,恒瑞将根据实际年净销售额向Novaliq 公司支付累计不超过 5,200万美元的里程碑款。 从 NOV03 在中国启动商业销售开始,恒瑞将根据实际年净销售额向Novaliq 公司支付累计不超过 9,200万美元的里程碑款。
四、 销售提成
从 CyclASol™和 NOV03 各自中国启动商业销售开始,恒瑞将按照约定比例, 根据实际年净销售额向 Novaliq 公司支付销售提成。年净销售额的提成比例区间为各自的 7%至 10%,随年净销售额的增加而梯度性增加。
Novaliq公司

Novaliq公司于2007年成立于德国海德堡,专注于开发和商业化基于全球首个无水药物递送技术平台EyeSol™®的眼科疗法。
截止2018年10月,Novaliq公司从dievini Hopp BioTech holding 获得了共计5300万美元的第6轮融资。mRNA头部企业CureVac的母公司,也就是著名的dievini Hopp Biotech Holding。
2021年4月Novaliq公司宣布,评估CyclASol®治疗干眼病(DED )迹象和症状的第二次3期临床试验已对834名目标患者随机分配超过50%,顶线结果预计将于2021年下半年公布。
CyclASol®的3期计划包括已完成328名患者的多中心、随机、双盲、溶剂组对照试验(ESSENCE-1),正在进行的3期试验(ESSENCE-2)旨在重新确认ESSENCE-1试验的疗效结果,以及多中心、非盲、单臂12个月安全扩展试验(ESSENCE-2 OLE)。ESSENCE-2结果如果为阳性,即可在2022年向美国食品和药物管理局提交新药申请(NDA)。
Novaliq临床开发副总裁Sonja Krösser博士表示:“尽管受新冠疫情环境影响,但通过对临床研究中心的仔细选择和支持,我们仍然非常成功地保证了ESSENCE-2试验很好的招募率。患者有机会参加非盲12个月安全扩展试验,我们很高兴地报告ESSENCE-2 OLE试验已完成招募,共有200名参与者。此两项招募里程碑的实现表明我们正在按照CyclASol®开发计划发展并将于2022年提交我们的第一个NDA。”
CyclASol®是一种局部抗炎和免疫调节眼科解决方案,在EyeSol®中含0.1%的环孢菌素A(开发用于治疗DED)。这种独特的无水制剂以EyeSol®增强型眼科生物有效性技术为基础,与水基或油基制剂相比,环孢菌素A的角膜渗透率高出几倍。这可产生CyclASol®治疗效果差异化,可在2周内早期见效和显著提高耐受性。上一次2B/3期临床试验ESSENCE-1评估了CyclASol®在DED患者中的疗效、安全性和耐受性,该试验已在《角膜:角膜和外部疾病期刊》上发表 。在这项研究中,CyclASol®与4周后的溶剂组对比,在DED迹象和症状预先指定的终点方面显示出显著的统计学改进。CyclASol®与更早的2期临床试验的结果一致,与其溶剂组相比,在监测眼表状况的角膜和结膜染色方面均有临床意义的改善,并在干燥症状方面有改善。此外,ESSENCE–1试验表明,随着角膜染色的减少,阅读速度有所提高。该试验的安全性和耐受性非常出色,应用舒适度得分非常出色,这通常仅以润滑眼滴报告。
正在进行的ESSENCE-2试验是一项多中心、随机、双盲、溶剂组对照的临床试验,用以评估CyclASol®在治疗DED迹象和症状方面的疗效、安全性和耐受性。该试验计划在美国25个临床中心招募约834名受试者。试验的主要终点是第29天的总角膜染色和眼部干燥评分对比基线的变化。该试验将再次包括对阅读速度的评估来作为视觉功能的客观和量化衡量。公司预计将在2021年第二季度公布ESSENCE-2的首要数据。
Novaliq首席执行官Christian Roesky博士表示:“我们衷心感谢参加此次研究的所有患者、研究人员和本地工作人员,以及感谢美国和海德堡的整个研发团队,感谢他们为实现这一重要里程碑所做的奉献和辛勤工作,特别是在新冠疫情带来更多复杂情况的环境下。
关于Novaliq
Novaliq是一家生物制药公司,专注于基于全球首款无水眼滴技术EyeSol®的一流和同类最佳眼科疗法的开发和商业化。Novaliq提供行业领先的产品组合,以满足数百万眼病患者当今尚未得到满足的医疗需求。Novaliq GmbH总部位于德国海德堡,Novaliq Inc.在美国马萨诸塞州剑桥设有办事处。长期股东是生命和健康科学公司投资机构dievini Hopp BioTech holding GmbH & Co. KG。


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://oss-personal-public.bcpmdata.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)



















 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论