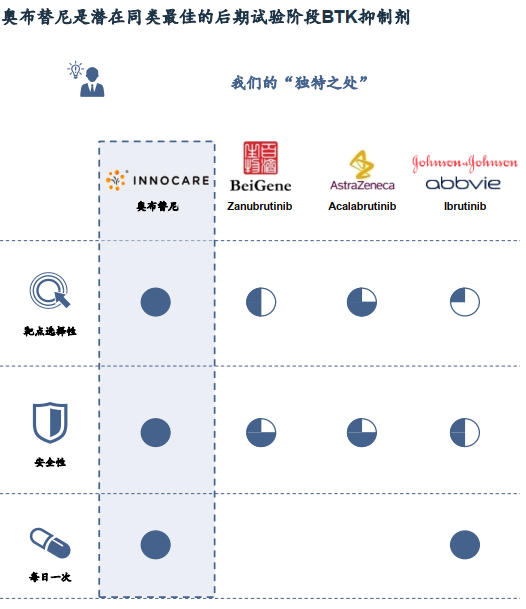
创造国产小分子新药授权首付之最
2021年7月,渤健(纳斯达克股票代码:BIIB)(Biogen)和诺诚健华(香港联交所代码:09969)(InnoCare)联合宣布,两家公司就有望治疗多发性硬化(MS)的口服小分子布鲁顿酪氨酸激酶抑制剂(BTKi)奥布替尼(orelabrutinib)达成许可及合作协议。奥布替尼是共价结合的BTK抑制剂,具有高选择性和血脑屏障渗透性,目前正在多国针对复发缓解型多发性硬化患者开展与安慰剂对照的 II 期临床研究。

一、本次交易细节(BD Deal)
根据协议条款,渤健将拥有奥布替尼在多发性硬化领域全球独家权利,以及除中国(包括香港、澳门和台湾)以外区域内的某些自身免疫性疾病领域的独家权利,诺诚健华将保留奥布替尼在肿瘤领域的全球独家权利,以及某些自身免疫性疾病在中国(包括香港、澳门和台湾)的独家权利。诺诚健华将获得1.25亿美元首付款(upfront),以及在达到合作约定的开发里程碑、商业里程碑以及销售里程碑时,有资格获得至多8.125亿美元的潜在临床开发里程碑和商业里程碑付款。诺诚健华还将有资格因合作约定的任何产品潜在未来净销售额获得在百分之十几范围内从低至高的分层特许权使用费。交易的完成取决于反垄断法审查,包括美国1976年的Hart-Scott-Rodino (HSR) 反垄断改进法案,以及其他完成条件惯例。
本款奥布替尼新药,创造国产小分子新药授权首付之最。药融云数据(www.pharnexcloud.com)显示,此前较为代表性的海外授权还有加科思的SHP2、复星医药旗下复创的BCL-2、微芯生物的西达本胺、豪森药业的EGFR 3代、艾力斯的EGFR 3代等等。(中国新药崛起趋势渐显,BD/交易合作加强;烨辉医药创始人—华烨:BD是License-in企业的重中之重)
二、关于奥布替尼
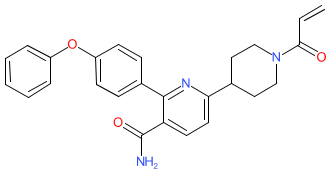
奥布替尼是一款小分子布鲁顿酪氨酸激酶抑制剂 (BTKi),已开发用于癌症的治疗以及正在开发用于自身免疫性疾病的治疗。在多发性硬化领域,奥布替尼是一款具有高选择性和血脑屏障渗透能力的BTKi,可在中枢神经系统实现高靶点占有率。目前正在开展一项针对复发缓解型多发性硬化患者(RRMS)的全球II期临床研究。


三、关于候选新药来源与研发历程
2011 年,崔霁松博士加入 PPD 中国子公司保诺科技,担任 CEO 兼首席科学官。2015 年,在保诺科技被知名全球资本收购之际,崔霁松博士做出了人生中的又一大选择。她和一群怀揣创新药研发梦想的同事共同成立了诺诚健华。施一公院士是诺诚健华的联合创始人兼科学顾问委员会主席,他为诺诚健华在新药发现和开发过程中提供科学建议。

药融云数据,www.pharnexcloud.com显示:2015年5月,诺诚健华从保诺科技旗下上海润诺生物收购BTK抑制剂全球权益(BTK专利WO2015048662)。到IND申报时对价:2000万人民币里程碑付款(此前首付400万人民币);上市后净销售额5%的基本交易合作模式。

2017年4月
诺诚健华向中国CDE申报了首款BTK新药ICP-022。
2017年7月
第一名患者于澳大利亚服用奥布替尼(ICP-022)。
2017年12月
奥布替尼(ICP-022)IND获CDE批准。

早期主要想做SLE/RA。后来变换了临床策略,改为血液瘤不同类型适应症。血液瘤临床推进速度快,重要靶点,在港股上市时赢得估值基石。
2019年2月
奥布替尼 (ICP-022) CLL II期试验患者招募完成。
2019年4月
奥布替尼 (ICP-022) MCL II期试验患者招募完成。
2019年5月
奥布替尼(ICP-022) IND于美国获FDA批准。
2019年8月
奥布替尼(ICP-022) CLL II期试验中最后一名患者完成六个疗程。
2019年10月
奥布替尼(ICP-022) MCL II期试验中最后一名患者完成六个疗程。
2019年11月
奥布替尼 (ICP-022)针对复发难治CLL/SLL的新药申请已提交予中国国家药监局(NMPA)并获受理。
2020年3月
在研BTK抑制剂奥布替尼 (ICP-022) 用于治疗复发/难治性套细胞淋巴瘤(MCL) 患者的新适应症上市申请(NDA)获得中国国家药监局受理。
2020年12月25日
获得中国国家药监局(NMPA)的上市许可,获批适应症:复发难治套细胞淋巴瘤(MCL)患者,及复发难治慢性淋巴细胞白血病(CLL) /小淋巴细胞淋巴瘤(SLL)。这其中体现了诺诚健华高效的临床执行力及与监管机构的沟通能力。自第一例患者入组到递交NDA申请:1.5年;自第一例患者入组到获得NDA批准:2.5年。

英雄不论出处,新药研发环节十分漫长,这款小分子候选新药虽然最早由保诺科技发现,但是后期申报IND,乃至申报NDA,无一不体现新药开发团队强大的能力。

近期,同济大学附属东方医院李进教授《中国抗肿瘤药物研发现状与挑战》的报告引起不小争议或共鸣,每个读者或者医药企业或者投资人有自己的看法。他提到:“中国个别企业专门挖社会主义“墙脚”,专门祸害中国新药创制。他搞一女嫁三夫,一个药/一个靶点设计五个不同的分子卖给不同的厂家,这样搞怎么可能有中国的新药创制?”笔者想,偶尔听一听警醒的话也无妨:中国新药毕竟还是在社会主义初级阶段发展中,期待中国新药的沉淀与崛起。

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论