
这是一个关乎“毁灭”与“重生”的故事。
上世纪50年代,沙利度胺曾因导致万名婴儿畸形而成为制药史上至暗时刻的代名词 。然而70年后,它却涅槃重生,进化为累计销售额近百亿美元的抗癌神药“瑞复美” 。
这颗小分子的命运逆转,不仅催生了现代药物监管标准,更开启了“分子胶”与PROTAC技术的全新时代 。
👀 历史的至暗时刻:“反应停”事件与监管觉醒
1. 错误的起点:从抗生素到镇静剂
故事始于20世纪50年代的瑞士。当时的制药巨头汽巴公司(Ciba,诺华的前身)正如火如荼地寻找新型抗菌药物。在1953年,其实验室首次合成了一种名为沙利度胺的化合物。化学家们对这种谷氨酸衍生物寄予厚望,然而药理学筛选的结果却令人失望:该化合物对细菌没有任何抑制活性。按照常规流程,这种失败的分子本应被丢进历史的废纸篓。
然而,命运的齿轮在德国药企格兰泰介入后发生了转动。格兰泰的研究人员在重新评估该化合物时,虽然确认了其无抗菌活性,却意外发现它具有显著的镇静和催眠作用。更为独特的是,它能极有效地抑制孕妇在妊娠早期的剧烈呕吐反应(晨吐)。在那个年代,市场上缺乏针对妊娠反应的安全药物,且当时的药理学认知普遍认为胎盘是一个完美的屏障,可以阻挡药物对胎儿的影响。
2. 狂热的市场推广与凯尔西的坚守
1957年,沙利度胺以“Contergan”(反应停)的商品名在欧洲上市。格兰泰公司的营销攻势极具误导性,他们宣称这是一种“无任何副作用的抗妊娠反应药物”,并特别推荐给孕妇使用。由于其在成人过量服用实验中未表现出致死毒性,这种“安全性”被无限放大。药物迅速风靡欧洲、澳大利亚、日本及拉丁美洲,仅在德国,每月的销量就达到了一吨之巨。
为了进军利润丰厚的美国市场,格兰泰授权梅里尔公司(William S. Merrell Company)向美国食品药品监督管理局(FDA)提交新药申请。1960年,这份申请落到了刚入职FDA一个月的弗兰西斯·凯尔西(Frances Kelsey)博士手中。凯尔西,这位拥有芝加哥大学药理学博士学位的女性,展现出了超越时代的职业素养和科学直觉。
在审阅梅里尔公司提交的数据时,凯尔西发现了一个致命的逻辑漏洞:申请材料中虽然大肆宣扬药物对成人的安全性,却完全缺乏针对孕期妇女的副作用数据。此外,她敏锐地注意到,该药物对人类有极强的催眠效果,但对实验动物却几乎无效。这种显著的物种差异暗示了药物代谢的复杂性——如果在动物身上无法复现药效,那么在动物身上获得的安全性数据又如何能外推至人类?
面对梅里尔公司高管的轮番施压,甚至是指责她“固执己见”,指责FDA官僚作风严重,凯尔西不为所动。她坚持要求补充关于药物对胎儿影响的安全性数据。这种在当时看来近乎苛刻的坚持,最终为美国筑起了一道防火墙。
3. 流行病学的噩梦
就在FDA与梅里尔公司僵持不下之际,大洋彼岸的灾难开始显现。1961年,澳大利亚产科医生威廉·麦克布里德(William McBride)在英国著名医学期刊《柳叶刀》上发表了一封通讯,报告了他在临床中观察到的异常现象:近期出生的海豹肢症患儿数量激增,这是一种极为罕见的先天性畸形,患儿的四肢发育不全,手脚直接连在躯干上,状如海豹。麦克布里德通过追溯病史,发现所有患儿的母亲在孕期均服用过沙利度胺。
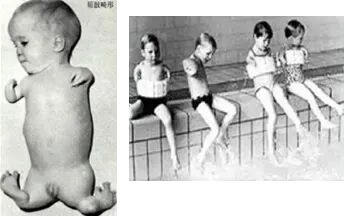
随后,各地医生也相继报告,发现海豹样肢体畸形的发生与沙利度胺存在关联。随着流行病学证据的确立,沙利度胺于1961年底开始在全球范围内撤市。然而,损害已经造成。据统计,全球共有超过1万名婴儿因沙利度胺导致严重畸形,这还不包括无数因药物导致的流产和死胎。而在美国,由于凯尔西博士坚定的立场与专业的判断,仅有极少数参与“调查性药物分发”的患者受到了影响。
4. 制度的遗产:科夫沃-哈里斯修正案
“反应停”事件成为了全球药物监管历史的分水岭。这场悲剧直接促成了1962年美国国会通过《科夫沃-哈里斯修正案》。该修正案彻底改变了FDA的职能,确立了现代药物审批的黄金标准:
① 有效性证明:药企不仅要证明药物是安全的,还必须通过严格的临床试验(Phase I-III)证明其是有效的。
② 知情同意:确立了受试者知情同意的伦理原则。
③ 不良反应报告:建立了上市后不良反应的监测和报告制度。
④ 临床前研究规范:强制要求在进行人体试验前,必须完成更为详尽的动物毒理学和致畸性研究。
👀 分子迷雾的消散:机理揭秘与致畸真相
在沙利度胺被禁后的几十年里,科学家们一直在试图解开一个谜题:为什么一个简单的化学小分子会造成如此特异且可怕的肢体畸形?直到21世纪,随着化学生物学技术的发展,这个黑箱才被彻底打开。
1. Cereblon (CRBN) 的发现:分子胶的诞生
2010年,日本东京工业大学的Takumi Ito团队在《Science》杂志上发表了一项里程碑式的研究。研究人员利用铁氧体-甲基丙烯酸缩水甘油酯(FG)磁珠偶联技术,从细胞裂解液中“钓”出了沙利度胺的直接结合靶点——一种名为Cereblon (CRBN) 的蛋白质。
CRBN并非一个孤立的蛋白,它是 CRL4 E3泛素连接酶复合体(Cullin-RING E3 Ligase 4)的核心底物识别亚基。该复合体由以下几个关键部分组成:
- CRBN:负责识别底物蛋白。
- DDB1(Damaged DNA Binding protein 1):作为适配器连接CRBN。
- Cul4A(Cullin 4A):作为骨架蛋白。
- Roc1(RBX1):负责招募E2泛素结合酶。
沙利度胺致畸作用机制
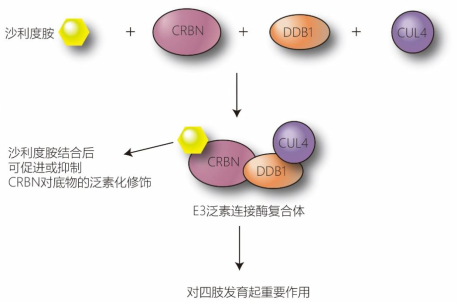
在正常生理状态下,CRBN识别特定的内源性蛋白并对其进行泛素化修饰,标记后的蛋白会被细胞内的“垃圾处理站”——26S蛋白酶体降解。研究发现,沙利度胺结合在CRBN表面的一个疏水口袋中(三色氨酸口袋),这种结合改变了CRBN的表面构象。这就好比给CRBN换了一副“眼镜”,使其能够识别并结合原本不属于其底物的蛋白质(即“新底物”),进而导致这些蛋白被错误地降解。这种机制后来被形象地称为“分子胶”作用。
2. 致畸机理:SALL4与物种差异
基于CRBN的发现,后续研究进一步揭示了致畸的具体路径。2018年发表在《Nature》等期刊上的研究指出,沙利度胺诱导CRBN降解的关键新底物是转录因子SALL4。
SALL4在胚胎发育过程中对四肢的形成至关重要。遗传学证据表明,人类SALL4基因的突变会导致Duane-Radial Ray综合征,其表型(拇指缺失、肢体短小、耳眼缺陷)与沙利度胺造成的畸形惊人地一致。更为精彩的是,这一发现完美解释了物种差异:
- 人类、灵长类和兔子:其SALL4蛋白序列中有一个特定的甘氨酸残基,使得它们在沙利度胺存在时会被CRBN识别并降解,因此对致畸敏感。
- 小鼠和大鼠:其SALL4对应位置是一个谷氨酸残基,这种细微的差异阻止了其与药物结合后的CRBN相互作用,因此啮齿类动物对沙利度胺的致畸性天然免疫。
这一发现不仅平反了当年梅里尔公司动物实验“无效”的困惑,也警示了在药物毒理学评价中选择合适动物模型的重要性。
3. 抗肿瘤机理:Ikaros与Aiolos的降解
同样的分子胶机制,在成熟的B细胞淋巴系统中却产生了抗癌疗效。在多发性骨髓瘤(MM)细胞中,沙利度胺及其衍生物诱导CRBN降解两个关键的锌指转录因子:
- Ikaros (IKZF1)
- Aiolos (IKZF3)
这两个因子是淋巴细胞发育和生存所必需的。它们的降解导致下游效应因子IRF4(干扰素调节因子4)和MYC的表达急剧下降,从而引发骨髓瘤细胞的周期阻滞和凋亡。同时,在T细胞中,Ikaros和Aiolos通常起抑制白介素-2(IL-2)表达的作用,它们的降解解除了这种抑制,导致IL-2分泌增加,激活了T细胞和NK细胞的免疫杀伤功能。这种“双重打击”——既直接杀伤肿瘤细胞,又激活免疫系统——构成了这类药物强大的临床疗效基础。
👀 绝地反击:新基公司的豪赌与来那度胺的诞生
1. 意外的转机:麻风病与Sheskin的发现
沙利度胺虽然被禁,但并未完全从地球上消失。1965年,以色列医生Jacob Sheskin在治疗麻风结节性红斑(ENL)——一种麻风病的痛苦并发症时,尝试给躁动不安的患者服用沙利度胺以助睡眠。令他震惊的是,患者不仅睡着了,醒来后皮肤红肿消退,疼痛奇迹般地缓解了。这一发现使沙利度胺在皮肤科和免疫科的特定领域得以“地下”延续。
2. 新基的入局:从环保到制药的跨越
时间来到20世纪90年代初。新基公司(Celgene)当时还只是一家专注于环境生物修复的小公司,由Sol Barer和David Stirling领导。为了转型制药,他们拜访了洛克菲勒大学的Gilla Kaplan教授,探讨抗结核药物的开发。Kaplan教授在研究中发现,沙利度胺能有效抑制TNF-α(肿瘤坏死因子-α),这正是ENL和艾滋病消瘦综合征的关键致病因子。
Kaplan建议新基开发沙利度胺。这在当时是一个疯狂的提议——一家小公司要去复活一个有着“恶魔”名声的药物。但新基的高管们看到了其中巨大的未满足临床需求。1992年,新基获得沙利度胺的独家授权。为了规避法律和道德风险,新基与FDA紧密合作,设计了极为严苛的风险管理计划——S.T.E.P.S.(沙利度胺教育与处方安全系统)。该系统强制要求每一位处方医生、药剂师和患者进行实名注册,并执行严格的避孕措施(包括男性患者)。1998年,FDA批准沙利度胺用于治疗麻风结节性红斑,这标志着该药物的正式回归。
3. 结构优化:去其糟粕,取其精华
尽管沙利度胺获批,但其副作用(嗜睡、便秘、周围神经病变)限制了其广泛应用。新基的化学家们开始对沙利度胺的分子结构进行改造,旨在保留其免疫调节活性,去除神经毒性。
沙利度胺的结构由左侧的邻苯二甲酰亚胺环和右侧的戊二酰亚胺环组成。
沙利度胺化学结构
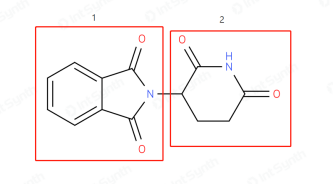
图源:摩熵化学
化学家们进行了两步关键的修饰:
① 泊马度胺(Pomalidomide):在对沙利度胺的1号环进行修饰时发现,引入氨基能够显著提升化合物的活性,基于此研发出泊马度胺。
泊马度胺化学结构
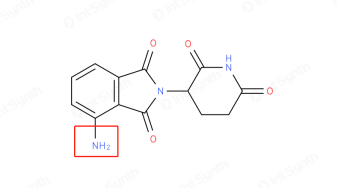
② 来那度胺(Lenalidomide):鉴于提升1号环稳定性的需求,通过减少一个酰胺基团的策略,对分子结构进行优化。历经深入研究与反复实验,最终成功获得来那度胺。
来那度胺化学结构

这一改造产生了代号为CC-5013的分子,即后来的来那度胺。与母体相比,来那度胺具有以下显著优势:
- 效力更强:对TNF-α的抑制能力强50-2000倍。
- 安全性更好:几乎没有镇静作用,极少引起周围神经病变。
- 稳定性更高:化学结构更加稳定。
4. 临床胜利:MDS与MM
来那度胺的临床开发策略极具针对性。
- 骨髓增生异常综合征(MDS):
2005年,来那度胺首先获批用于治疗伴有5q染色体缺失(del(5q))的低中危MDS。在这类患者中,来那度胺展现了惊人的疗效:在MDS-003试验中,67%的输血依赖患者完全脱离了输血。后来的机制研究表明,这是因为del(5q)细胞中半倍体剂量的CSNK1A1(编码CK1α)基因使细胞对来那度胺诱导的CK1α降解高度敏感,产生“合成致死”效应
- 多发性骨髓瘤(MM):
2006年,基于两项大型III期临床试验(MM-009和MM-010),FDA批准来那度胺联合地塞米松治疗复发/难治性多发性骨髓瘤。数据显示,该联合疗法显著延长了患者的总生存期(OS)和无进展生存期(PFS)。随后的研究将其适应症推进到一线治疗(MM-020/FIRST试验)和造血干细胞移植后的维持治疗,彻底改变了骨髓瘤的治疗格局,使其从一种快速致命的癌症转变为一种可控的慢性病。
👀 商业帝国:瑞复美的崛起与专利护城河
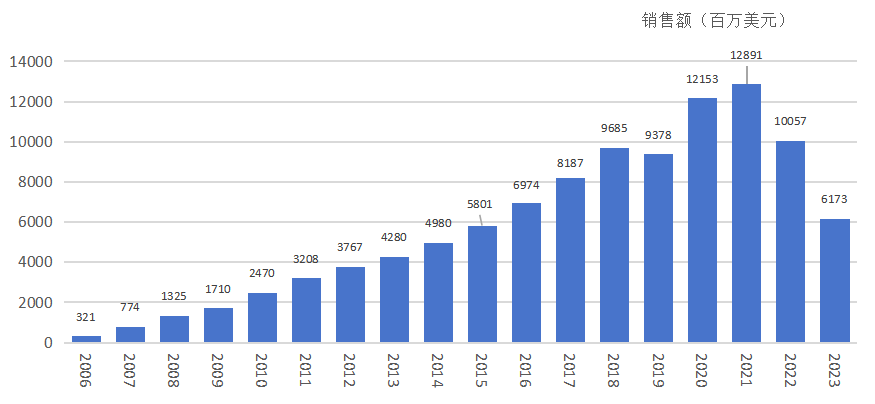
1. 百亿美元的重磅炸弹
来那度胺(商品名:瑞复美/Revlimid)上市后,凭借其卓越的疗效和不断扩展的适应症,销售额呈指数级增长。
- 2006年:销售额3亿美元。
- 2008年:突破10亿美元。
- 2010年:随着适应症拓展至一线治疗,销售额突破20亿美元。
- 2020年:全球销售额突破120亿美元,成为全球最畅销的肿瘤药物之一。
- 累计销售:截至2021年底,其累计销售额达到了惊人的879亿美元。
瑞复美历年销售额
2. 专利丛林与REMS壁垒
新基公司为了延长瑞复美的生命周期,构建了坚不可摧的商业护城河:
(1)孤儿药身份:利用MDS和MM的孤儿药地位获得市场独占权。
(2)专利网:除了化合物核心专利外,新基申请了大量关于晶型、合成工艺、给药方案以及REMS分发系统的外围专利。
(3)REMS作为商业武器:新基利用FDA强制的风险管理计划(REMS),严格控制药物分发。当仿制药公司(如Mylan, Dr. Reddy's)试图购买参比制剂进行生物等效性试验时,新基以“安全风险”为由拒绝供货。这导致了长达数年的反垄断诉讼,但也成功推迟了仿制药的上市时间。
3. 专利悬崖与BMS的收购
2019年,百时美施贵宝(BMS)宣布以740亿美元收购新基。尽管当时已知瑞复美面临专利悬崖,但BMS看重的是其带来的强劲现金流以及新基在血液瘤领域的深厚管线。
为了解决专利纠纷,新基与纳科(Natco)、雷迪博士(Dr. Reddy's)、Alvogen等仿制药企达成了和解协议:允许这些公司从2022年3月起销售限量的仿制药,并在2026年1月31日后完全放开限制。
现实冲击:正如预测,随着2022年限得仿制药的入场,瑞复美的销售额开始下滑。BMS财报显示,2023年瑞复美全球收入下降至约60亿美元(相比巅峰期腰斩),2024年这一趋势继续,主要受到Teva、Cipla等公司仿制药的激烈价格竞争影响。
👀 CRBN调节剂最新进展概览
1. 研发格局与管线分布
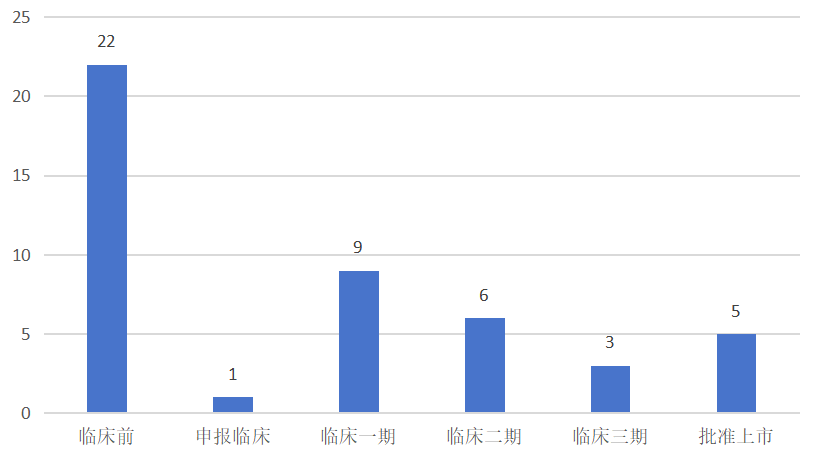
据摩熵医药数据库的全球药物研发数据库数据统计(截至2025年1月22日),全球在研CRBN调节剂(涵盖创新药与改良型新药)总计达46款。
- 研发阶段分布: 已上市5款,III期3款,I/II期15款,临床前22款。
- 领军企业: 新基公司(现百时美施贵宝/BMS)在该领域处于绝对领先地位,囊括了目前进展最快的三款III期产品。
2. 核心III期产品临床进展
目前处于临床III期的三款药物均由BMS开发,具体进展如下:
Mezigdomide(多发性骨髓瘤)
机制:通过促进IKZF1/IKZF3泛素化降解,抑制恶性浆细胞增殖。
数据(NEJM, 2023):在I/II期研究中(联用地塞米松),针对难治性患者实现了 41%的总体缓解率(ORR),中位无进展生存期(mPFS)为4.4个月。
安全性:主要为中性粒细胞减少及感染,未见意外毒性,目前III期试验正在进行中。
Iberdomide(多发性骨髓瘤)
数据(Lancet Haematology, 2022):在I/II期研究中(联用地塞米松),剂量扩展队列的 ORR为26%,mPFS为3.0个月,预估中位总生存期(OS)为10.7个月。
安全性:整体可控,最常见不良反应为中性粒细胞减少和贫血。
Golcadomide(B细胞淋巴瘤)
进展:作为新型E3泛素连接酶分子,目前已开启全球III期临床。
数据:在针对B细胞淋巴瘤的I/II期研究中,展现出高达 91.1%的客观缓解率。
3. 技术应用延伸:PROTAC
CRBN不仅作为直接药物靶点,也是开发PROTAC(蛋白降解靶向嵌合体) 药物最广泛使用的E3泛素连接酶配体之一。PROTAC是一种借助泛素-蛋白酶体系统对靶蛋白进行降解的药物开发技术。目前进展最快的PROTAC药物 ARV-471(已进入III期)即采用CRBN作为配体,预示着CRBN调节剂在双功能分子设计领域的广阔前景。
随着瑞复美的光环褪去,BMS及整个制药界已将目光投向了基于Cereblon通路的下一代技术。
👀 结语与启示
从1957年Contergan的上市,到2025年CELMoDs和PROTACs的百花齐放,这段近70年的历史不仅是药物研发的缩影,更是人类认知边界拓展的见证。
① 风险与收益的辩证:沙利度胺的故事告诉我们,没有绝对“安全”的药物,只有在特定情境下收益大于风险的选择。新基公司通过建立严格的风险管理体系(REMS),成功将一个由于致畸而被唾弃的药物转化为救命良药,这证明了监管科学与临床科学结合的巨大价值。
② 老药新用的潜力:沙利度胺的复活并非孤例,但在深度和广度上无出其右。它提醒制药界,在追求First-in-class新分子的同时,深入挖掘现有分子的新机理(如从抑制剂到降解剂的思维转变),可能带来更具颠覆性的创新。
③ 科学的意外之喜:如果不是为了研究致畸机理而发现了CRBN,我们可能至今仍无法开启靶向蛋白降解的大门。基础科学对机理的执着探索,往往能在意想不到的地方结出硕果。
随着瑞复美专利时代的结束,我们并未看到终点,而是站在了Cereblon生物学应用的新起点。无论是更强效的CELMoDs,还是万能的PROTACs,这颗曾在至暗时刻几乎毁灭了公众对制药工业信任的分子,如今正引领着攻克癌症和难治性疾病的全新浪潮。
扩展阅读:
2. 欧美完成GMP认证互认 中国制药企业需高度关注最新动向
想要解锁更多药品信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论