
在HER2阳性早期乳腺癌的III期注册试验中观察到迄今最高*的病理完全缓解率,且与标准治疗相比安全性特征良好
DESTINY-Breast11研究与DESTINY-Breast05研究在ESMO主席研讨会上共同发布,进一步强化了阿斯利康和第一三共的德曲妥珠单抗在以治愈为目标的早期乳腺癌治疗中,有望成为基石疗法的潜力
DESTINY-Breast11 III期研究积极结果显示,优赫得(通用名:德曲妥珠单抗)序贯THP方案(紫杉醇、曲妥珠单抗及帕妥珠单抗)作为新辅助治疗(术前)方案,在病理完全缓解率(pCR)方面表现出显著统计学意义和临床意义的改善。该研究对比了德曲妥珠单抗序贯THP方案与剂量密集型多柔比星与环磷酰胺序贯THP(ddAC-THP)方案在高风险、局部晚期HER2阳性早期乳腺癌患者中的治疗结果。病理完全缓解定义为治疗后在切除的乳房组织和淋巴结中无浸润性癌细胞证据。
在DESTINY-Breast11研究中,德曲妥珠单抗序贯THP方案的病理完全缓解率达67.3%,而ddAC-THP方案的病理完全缓解率为56.3%,病理完全缓解率提升了11.2%。在激素受体(HR)阳性和HR阴性亚组中均观察到病理完全缓解率的提升(HR阳性组:61.4% 对比 52.3%;HR阴性组:83.1% 对比 67.1%)。此外,术后,德曲妥珠单抗序贯THP方案组中接受新辅助治疗的患者,有81.3%在切除的乳房或淋巴结组织中未检测到或仅检测到极少量浸润性残余癌(残余肿瘤负荷[RCB] 0+I),而对照组患者的这一比例为69.1%。
在本次分析中,无事件生存期(EFS)作为次要终点数据尚未成熟(数据截⽌时成熟度为4.5%);然而早期分析显示,德曲妥珠单抗序贯THP方案相较于ddAC-THP方案呈现出获益的趋势(风险比 0.56;95%置信区间 0.26-1.17)。
德国慕尼黑大学附属医院妇产科与乳腺中心主任、慕尼黑综合癌症中心 (CCCMunich)主任、医学与哲学博士,该临床试验的主要研究者Nadia Harbeck博士表示:“对于存在高复发风险的早期乳腺癌患者,尽早采用最有效的治疗方案对于预防复发、优化安全性并提高治愈可能至关重要。在DESTINY-Breast11试验中,超过三分之二的患者在接受德曲妥珠单抗序贯THP方案治疗后获得了病理完全缓解,表明该方案有望成为高危HER2阳性早期乳腺癌患者新辅助治疗领域的新标准。”
阿斯利康全球执行副总裁,全球肿瘤研发负责人高书璨(Susan Galbraith)表示:“早期乳腺癌治疗的目标是为患者提供最佳的治愈机会,同时优化治疗方案的耐受性。DESTINY-Breast11研究中,德曲妥珠单抗序贯THP方案展现出了令人瞩目的病理缓解率和良好的安全性,有望改变新辅助治疗的格局,并凸显了将德曲妥珠单抗应用于HER2阳性疾病早期治疗阶段的重要性。”
第一三共全球研发负责人Ken Takeshita博士表示:“在HER2阳性早期乳腺癌中,实现病理完全缓解对于降低疾病复发和改善长期预后至关重要。但就目前可用的新辅助治疗方案而言,约一半的患者在术后显示仍有残余病灶。DESTINY-Breast11研究结果表明,术前采用德曲妥珠单抗序贯THP方案治疗后,三分之二的患者未检测到残余浸润性病灶,这也标志着十余年来首个能在HER2阳性乳腺癌最早期治疗阶段就能显著改善患者预后的治疗方案。
DESTINY-Breast11研究结果摘要i,ii
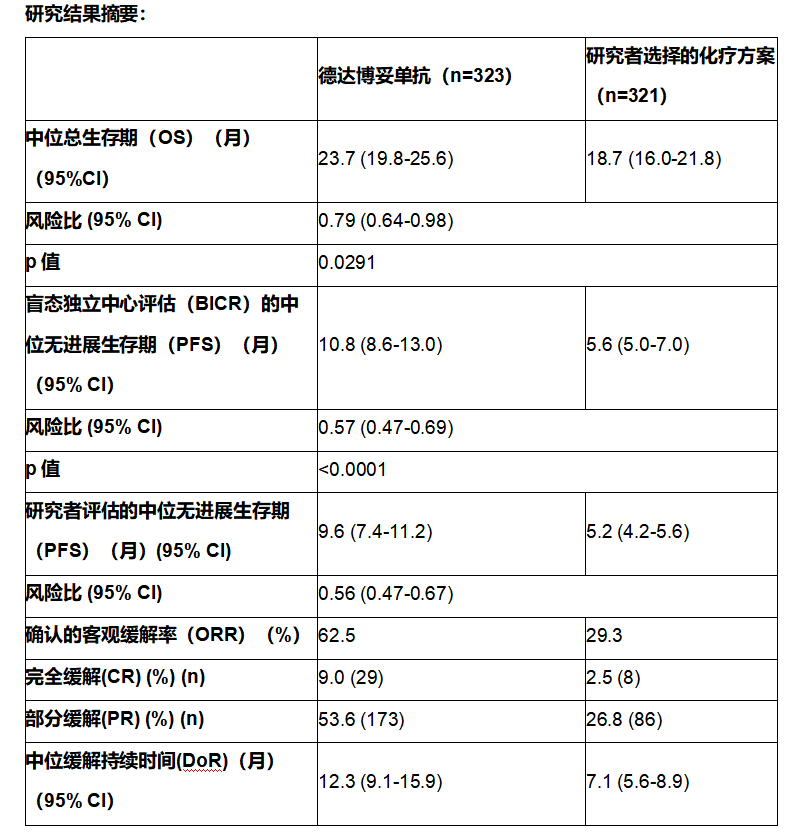
THP,紫杉醇、曲妥珠单抗和帕妥珠单抗;ddAC,剂量密集型多柔比星和环磷酰胺;pCR,病理完全缓解;HR,激素受体;CI,置信区间;RCB (0+I),残余肿瘤负荷;EFS,无事件生存期。
i数据截⽌⽇期为2025年3⽉12⽇;德曲妥珠单抗序贯THP方案组的中位随访时间为24.2个⽉,ddAC-THP方案组为23.6个⽉。
ii 基于盲态中心评估。
iii 病理完全缓解者定义为仅接受随机研究治疗(至少一剂)并达到病理完全缓解的患者。 iv 采用分层Miettinen & Nurminen方法;p值已跨越预设的0.03界限。
v 残余癌负荷(RCB)基于原始数据,未对未开始治疗者或任何桥接/脱离研究的新辅助治疗进行校正;因此,病理完全缓解(pCR)与RCB-0之间可能存在差异。
vi 在中期分析时,无事件生存期(EFS)的成熟度为4.5%。
在DESTINY-Breast11研究中,德曲妥珠单抗序贯THP方案的安全性特征与各单药已知的安全性特征一致,未发现新的安全性问题。
德曲妥珠单抗序贯THP方案相较于ddAC-THP方案展现出良好的安全性特征,3级及以上不良事件(AEs)发生率(37.5%对比55.8%)、严重不良事件发生率(10.6%对比20.2%)、治疗中断率(37.8%对比54.5%)以及左心室功能障碍发生率(1.3%对比6.1%)均有所降低。
间质性肺病(ILD)的发生率较低,且各治疗组之间发生率相似,德曲妥珠单抗序贯THP方案组患者的ILD事件发生率为4.4%,ddAC-THP方案组为5.1%。大多数ILD事件为低级别(1级和2级)。德曲妥珠单抗序贯THP方案组有1例3/4级事件,ddAC-THP方案组有5例3/4级事件。经独立裁定委员会判定,两个治疗组均有1例5级ILD事件。
DESTINY-Breast11研究结果(摘要#291O)于2025年10月18日在德国柏林举行的2025年欧洲肿瘤内科学会(ESMO)年会上,于大会主席研讨会I环节公布,同时公布的还有DESTINY-Breast05 III期临床研究结果(摘要#LBA1)。DESTINY-Breast11研究结果也将在ESMO会议期间同步发表于《肿瘤学年鉴》(Annals of Oncology)上。
基于DESTINY-Breast11研究结果,德曲妥珠单抗序贯THP方案的补充生物制品的许可申请目前正由美国食品药品监督管理局(FDA)审评。
德曲妥珠单抗是⼀款靶向HER2的抗体偶联药物(ADC),采用第一三共专有的DXdADC技术设计,由第一三共和阿斯利康共同开发和商业化。





















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论