
12月2日,阿斯利康对外宣布,已向美国食品药品监督管理局(FDA)提交 Baxdrostat 的新药申请,且该申请已获FDA授予优先审评资格。Baxdrostat 拟作为其他抗高血压药物的辅助治疗药物,用于治疗经其他药物无法充分降低血压的难治性高血压(未控制或治疗抵抗)成年患者。
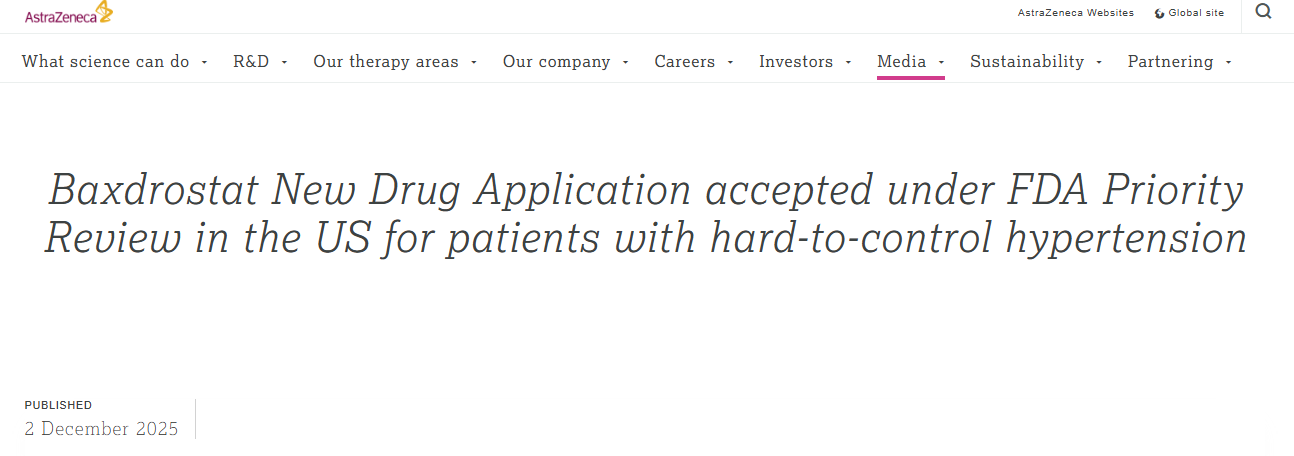
截图来源:阿斯利康官网根据
相关安排,处方药用户付费法案(PDUFA)的生效日期预计在2026年第二季度。此外,新闻稿特别指出,若 Baxdrostat 能获批上市,其有望成为首个获监管机构批准的醛固酮合成酶抑制剂。
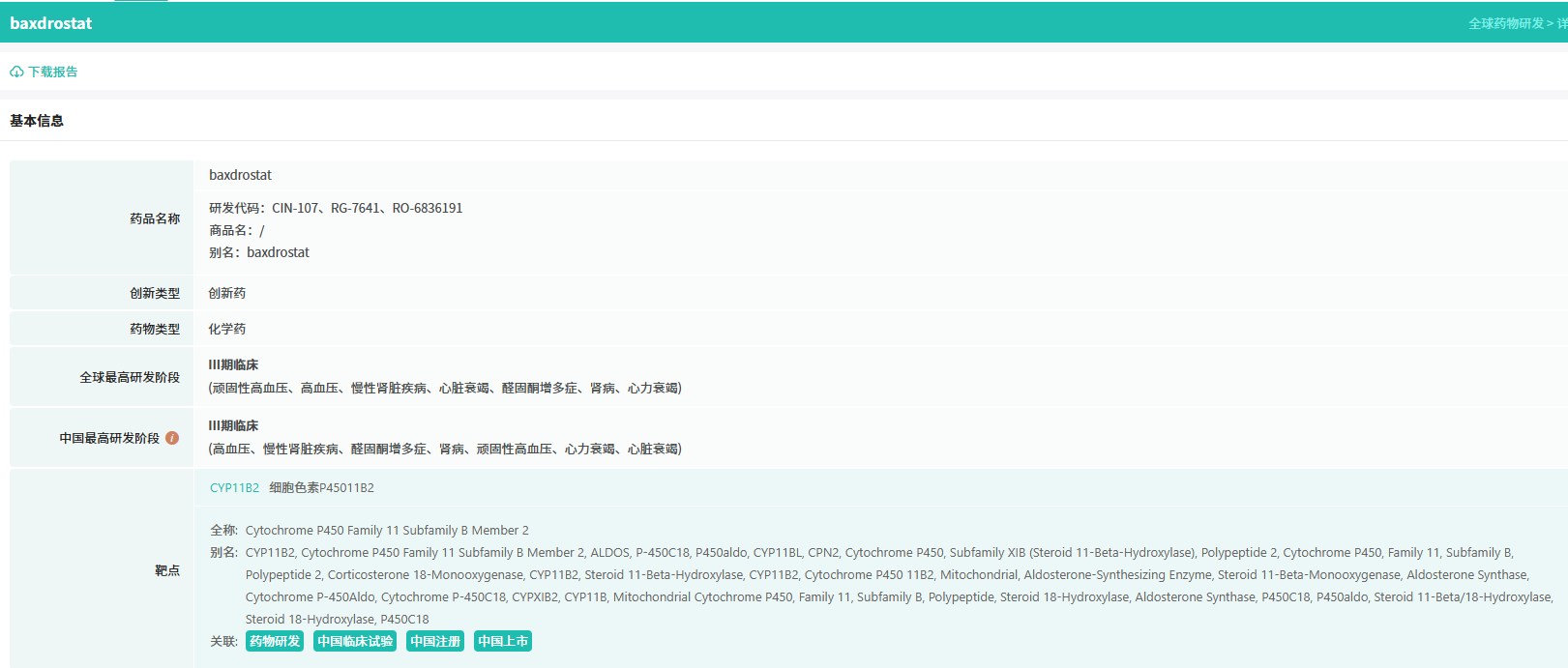
截图来源:摩熵医药数据库-全球药物研发数据库
此次新药申请是基于 III 期试验 BaxHTN 的数据。BaxHTN 是一项多中心、随机、双盲、安慰剂对照、平行分组的 III 期研究,旨在评估 Baxdrostat 在接受两种不同降压药物治疗但血压仍控制不佳的高血压患者,以及接受三种或以上降压药物(其中包括一种利尿剂)治疗但血压仍控制不佳的高血压患者中的安全性、耐受性及疗效。
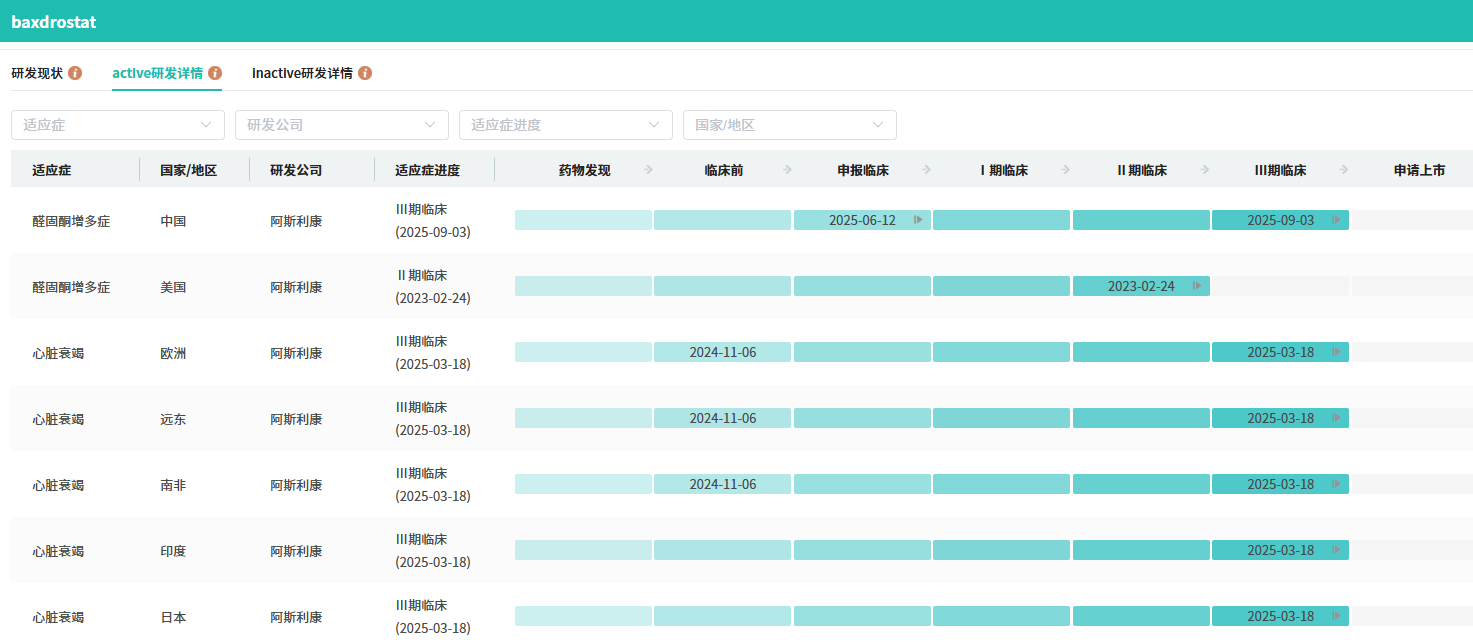
截图来源:摩熵医药全球药物研发数据库
此外,Baxdrostat 达成所有确认性次要终点:2mg剂量组降压效果持久,2mg与1mg剂量组舒张压降低更显著,患者收缩压<130mmHg的达标率较安慰剂组提升近三倍。
Baxdrostat 是高选择性、强效口服小分子首创新药,可抑制由CYP11B2基因编码、负责肾上腺醛固酮合成的醛固酮合酶。2023年2月,阿斯利康18亿美元收购CinCor Pharma将其收入囊中。目前,除已申报上市的高血压适应症外,其还在开展慢性肾脏病、心力衰竭等多适应症临床研究。
参考来源:
[1] 企业官网/官方披露
[2] 摩熵医药(原药融云)数据库
扩展阅读:
1. 阿斯利康小分子PCSK9抑制剂在中国获批临床!血脂管理迎新突破
2. 阿斯利康PD-L1抗体Imfinzi引领膀胱癌治疗新突破:III期试验获积极结果
3. 阿斯利康1类新药AZD5492在中国获批临床,有望提高B细胞淋巴瘤疗效
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论