3月30日晚间,华东医药发布公告,该公司全资子公司中美华东制药收到国家药品监督管理局(NMPA)核准签发的《药品注册证书》,由中美华东制药申报的利拉鲁肽注射液(商品名:利鲁平®)“适用于成人2型糖尿病患者控制血糖”的上市许可申请获得批准。据悉,华东医药是国产首家获批该糖尿病新药的企业。

截图来源:华东医药发布公告
利拉鲁肽的原研企业为丹麦诺和诺德公司,为GLP-1(人胰高血糖素样肽-1)受体激动剂,与人GLP- 1具有97%的序列同源性,临床主要用于改善成年人2型糖尿病(T2DM) 的血糖控制,在海外也被获批用于肥胖或体重超重患者的治疗,是公司的糖尿病新药。
诺和诺德利拉鲁肽关于糖尿病的适应症于2009年获得欧洲药品管理局(EMA)批准,2010年获得美国FDA批准,商品名:Victoza®,2011 年获得中国国家食品药品监督管理局(现中国国家药品监督管理局, NMPA)批准,商品名:诺和力®。
原研利拉鲁肽注射液的肥胖或超重适应症于2014年获得美国FDA批准,2015年获得EMA批准,商品名:Saxenda®,截至目前该适应症尚未在国内获批。
利拉鲁肽全球研发现状(微信搜索"药融云小程序"进行相关更多数据查询)
截图来源:药融云全球药物研发数据库
GLP-1类似物是新世纪以来开发的新品,自利拉鲁肽问世以来,诺和诺德就一直在统治GLP-1类似物市场。作为经典的靶向GLP-1糖尿病新药,利拉鲁肽在国内外市场销售量均保持快速增长。据诺和诺德公司2022年财报数据显示,利拉鲁肽降糖针(Victoza)、利拉鲁肽减肥针(Saxenda)的销售额分别为123.22亿丹麦克朗(18.68亿美元)、106.76亿丹麦克朗(15.08亿美元),共计约230丹麦克朗,换算成人民币约为229亿元。
利鲁平®产品包装(预填充注射笔及笔芯)
在国内市场,据药融云全国医院销售数据库显示,利拉鲁肽近几年的销售额一直是水涨床高,保持着呈逐年递增趋势。2021年销售额大涨63%,首次突破亿元大关,直达14.2亿,现2022年前三季度也已超十亿,市场动力十足。2023年3月1日,2022年最新版医保目录发布,利拉鲁肽注射液谈判成功,被纳入乙类,限用于血糖控制不佳的成人2型糖尿病患者。
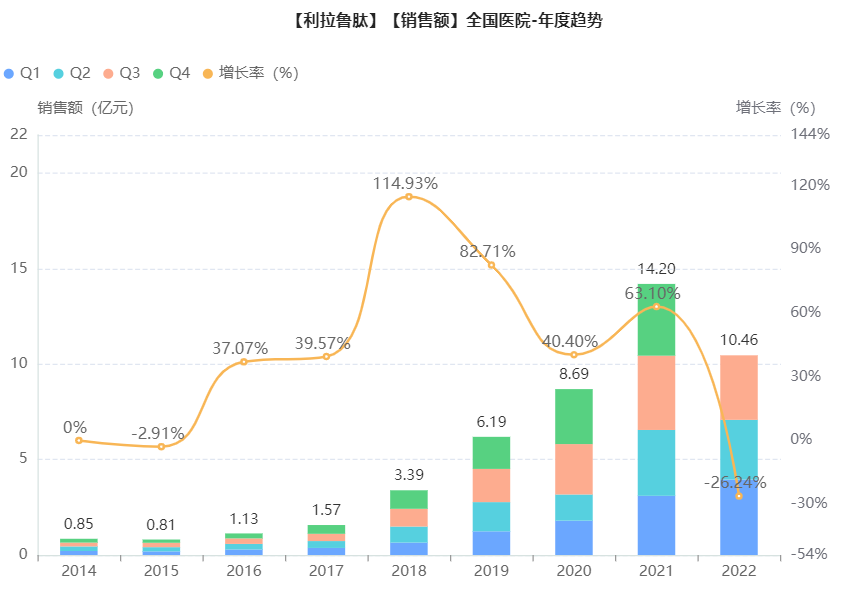
截图来源:药融云全国医院销售数据库
根据国际糖尿病联盟IDF数据显示,我国是全球糖尿病第一大国,患者数量居全球第一,呈持续快速增长趋势。2021年中国20-79岁糖尿病人数达到1.41亿人,其中,90%以上是2型糖尿病,预计2045年上升至1.74亿人。国内多上市一款糖尿病新药,就能为患者提供多一种可选择的机会。
经药融云数据库查询显示,目前国内仅有华东医药及原研诺和诺德拥有利拉鲁肽注射液的上市批文,这意味着,利鲁平®是国产首款获批上市的利拉鲁肽注射液,未来国内市场空间广阔。除本次获批上市的糖尿病适应症外,中美华东制药也于2022年7月作为国内首家向NMPA递交了利拉鲁肽注射液用于肥胖或超重适应症的上市许可申请,并获得受理。
另外,除华东医药外,国内还有正大天晴/连云港润众制药、翰宇药业、通化东宝药业在2022年先后也递交了该糖尿病新药的上市申请,均在审批审批中。利拉鲁肽注射液国产第二家或将从中决出。
国产利拉鲁肽注射液新药申报上市情况
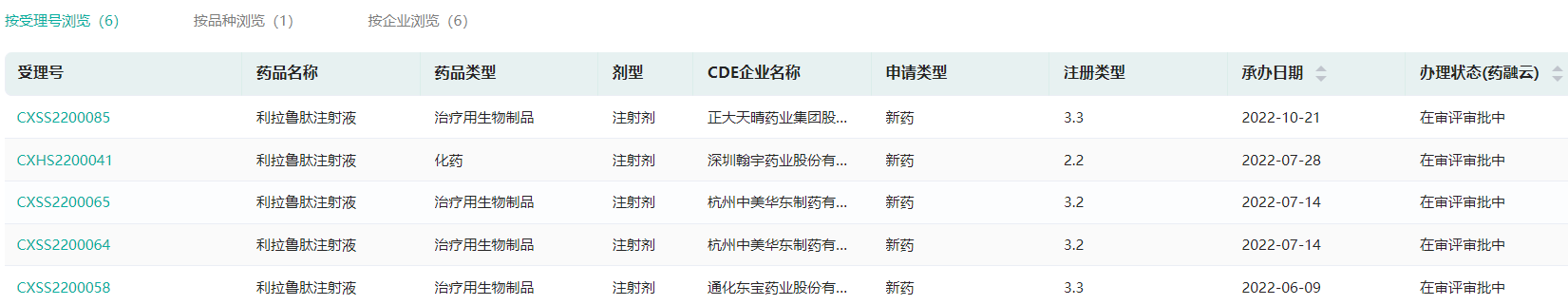
截图来源:药融云中国药品审评数据库
作为极具潜力的糖尿病新药产品,本次华东医药利拉鲁肽注射液获批上市,将进一步丰富公司在糖尿病领域的产品管线,在市场推广方面将与公司该领域现有重点品种共享专家网络、研究及临床资源,形成有效协同,进一步强化提升华东医药在糖尿病用药领域的市场竞争力,以及巩固其在国内的领先地位。
信息参考:
[1] 药融云数据库
[2] 华东医药公司官方披露
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论