2023年6月21日,Pieris Pharmaceuticals(NASDAQ:PIRS)是一家临床阶段的生物技术公司,通过其专有的Anticalin®技术平台推进新型生物疗法,用于呼吸系统疾病和癌症适应症。该公司宣布,合作伙伴阿斯利康决定停止哮喘药物elarekibep的中期试验,此前一项非临床毒理学研究数据显示,elarekibep会导致炎症相关的肺组织损伤。Elarekibep是一种正在开发用于治疗哮喘的吸入性IL-4Rα单抗。

据药融云数据库,目前全球仅赛诺菲的度普利尤单抗一款IL-4Rα单抗获批上市,主要用于哮喘、特应性皮炎等症的治疗,2022年全球销售额87亿美元,同比增长43%。目前国内康诺亚领先优势明显,2023年3月28,康诺亚公告IL-4Rα单抗CM310治疗中重度特应性皮炎的III期确证性临床研究已完成揭盲及初步统计分析,所有研究终点均成功达到。康诺亚有望成为首个获批上市的IL-4国产抗体药,享受该靶点的国内市场红利。
全球IL-4Rα单抗研发现状(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)
截图来源:药融云全球药物研发数据库
两家公司于2017年合作研究了当时处于临床前的elarekibep,阿斯利康向Pieris支付了近6000万美元,同时还向该公司支付了另外四种针对未公开呼吸道靶点的新药。根据协议条款,Pieris将推动这款当时被简称为PRS-060的IL-4Rα单抗进入I期试验,而阿斯利康将资助临床开发和商业化项目。
截图来源:药融云全球医药交易数据库
阿斯利康的终止研发的这一决定是基于对干粉吸入剂配制的elarekibep进行的一项为期13周的非临床GLP毒理学研究的结果,与正在进行的临床研究无关,但研究结果不支持elarekibep的长期使用以及临床后期开发。阿斯利康的决定独立于2a期研究的任何数据。Pieris将加快对数据和阿斯利康的决定对该项目的影响进行审查,并在分享进一步更新之前,将审查其整体公司优先事项。
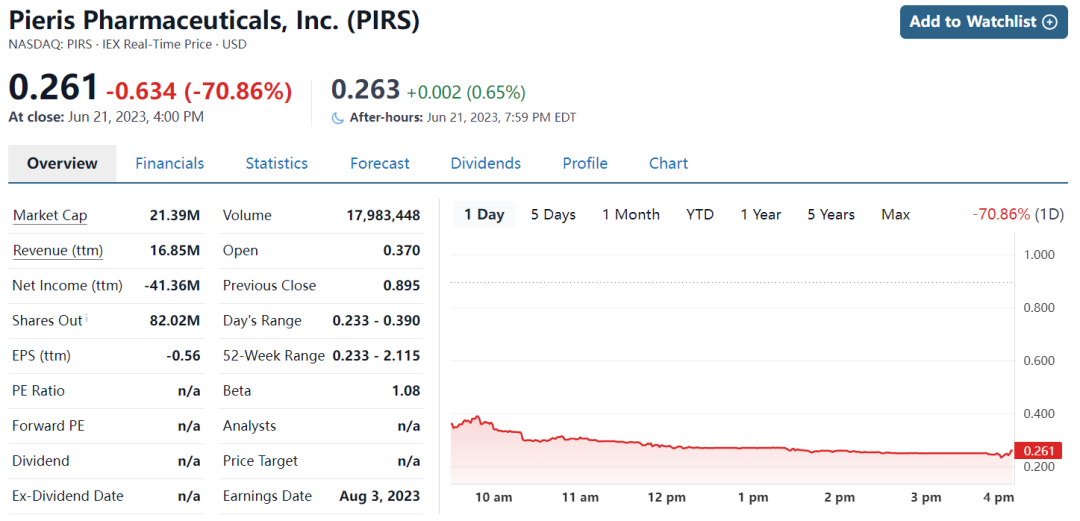
受到此消息影响,Pieris股价大跌70%,市值仅剩0.2亿美元。
这项为期13周的非人灵长类动物研究包括三个活性剂量组。AstraZeneca得出结论,在任何剂量组中都没有临床观察结果,但存在呼吸道病理学发现。这些发现包括炎症介导的肺组织损伤,看起来与剂量无关。
“我们对这些非临床研究结果感到失望。尽管elarekibep已经开始在2a期研究的疗效部分招募研究对象,但该项目的后期开发需要支持性的更长期的非临床毒理学数据。”Pieris的总裁兼首席执行官Stephen Yoder表示,“我们现在将重新评估我们的优先事项,并在对我们的选择进行彻底审查后尽快发布企业更新。我们非常重视AstraZeneca为elarekibep承诺的专业知识和资源,并感谢许多医生、患者和照护人员对该研究的支持。”
Pieris研发管线

据Pieris的2023Q1财报,一季度营收193万美元,研发费用支出1342万美元,目前在手现金及等价仅剩3974万美元,公司目前的候选药物都处于早期开发阶段,未来对资金的需求仍然较大,本次终止IL-4Rα单抗2a期临床试验对这家biotech的打击还是很大的。
参考资料:
[1] 药融云数据库
[2] https://www.pieris.com/investors/news-events/press-releases/detail/702/pieris-pharmaceuticals-announces-astrazeneca
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论