
2023年10月31日,美国FDA批准了Wezlana (ustekinumab-auub)作为畅销药物Stelara (ustekinumab)的可互换生物仿制药,用于治疗多种炎症性疾病。

图片来源:官方网站
重磅“炸弹”乌司奴单抗,迎来首个生物仿制药
Stelara(通用名:ustekinumab,乌司奴单抗)是强生公司开发的一种全人源“双靶向”白细胞介素12(IL-12)和白细胞介素23(IL-23)抑制剂,用于治疗斑块型银屑病、银屑病关节炎、克罗恩病和溃疡性结肠炎等,有静脉注射和皮下注射两种剂型。
Wezlana 是由Amgen(安进)开发,与Stelara一样,被批准用于治疗以下适应症:
(1)适合光疗或全身治疗的中度至重度斑块型银屑病的成人和儿童患者;
(2)患有活动性银屑病关节炎的成人和儿童患者;
(3)患有中度至重度活动性克罗恩病的成人;
(4)患有中度至重度活动期溃疡性结肠炎的成人。
FDA对Wezlana的批准是基于III期试验的研究结果。该研究是一项多中心、随机、双盲、对比临床试验,符合主要疗效终点,表明生物仿制药与Stelara相比没有临床意义上的差异。该分析评估了患有中度至重度斑块型银屑病的成年患者在12周内银屑病面积严重指数百分比的变化。总共有563名患者随机接受生物仿制药(n = 281)或参考产品(n = 282)。
III期试验数据证实了Wezlana与Stelara高度相似,两种产品在安全性、纯度和效力方面没有临床意义上的差异。这些证据包括在分析水平上使用测试和分析对产品进行的比较,证实了Wezlana和Stelara在结构和功能特征上的相似性,以及人类药代动力学数据、临床免疫原性数据和其他临床安全性和有效性数据的比较。
Wezlana基本信息查询
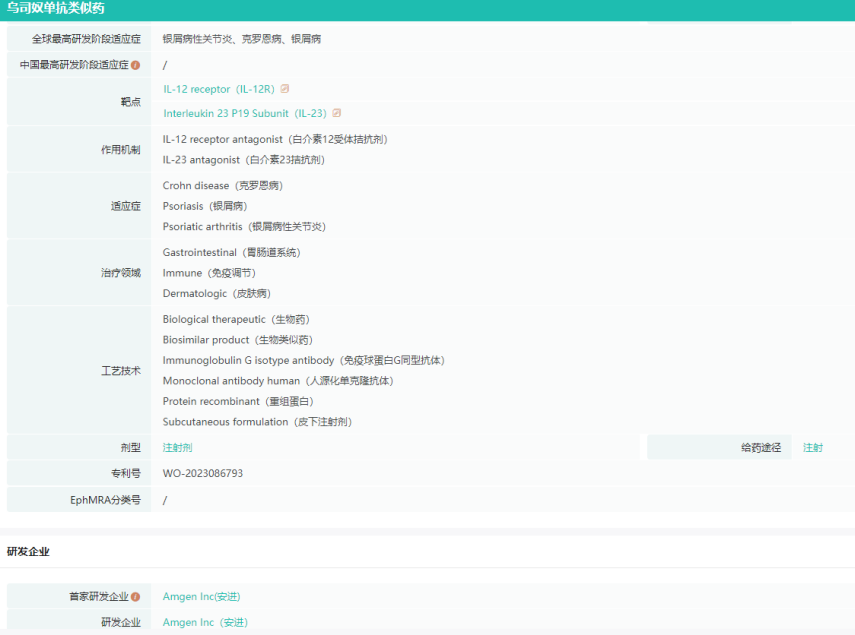
图片来源:药融云全球药物研发数据库
互换指定将允许Wezlana在药房级别替代Stelara,而无需药剂师首先获得提供者的许可。此批准可以为多种炎症性疾病患者提供更多安全、高质量并且有成本效益的治疗选择。
Wezlana是第七个被认为可互换的生物仿制品,其余六个分别是:Semglee (甘精胰岛素-yfgn), Cyltezo (阿达木单抗-adbm), Cimerli (ranibizumab-eqrn), Rezvoglar (甘精胰岛素-aglr), Byooviz (ranibizumab-runa), and Abrilada (adalimumab-afzb)。
百亿银屑病用药市场,聚集多款“重磅炸弹”
据统计,全球有1.25亿人患有银屑病,其中大约80%的银屑病患者患有斑块型银屑病。2022 年全球银屑病用药市场规模已达185 亿美元。该领域已经聚集强生的Stelara(乌司奴单抗)、艾伯维的Humira(修美乐,阿达木单抗)、诺华的Cosentyx(司库奇尤单抗)等多款“重磅炸弹”。
药融云数据库显示,Stelara在2008年首次于加拿大获批,随后相继在欧盟、美国、日本等国获批。后于2017年11月首次在中国获批(商品名:喜达诺),用于治疗中重度斑块状银屑病。
Stelara中国批准文号研发历程
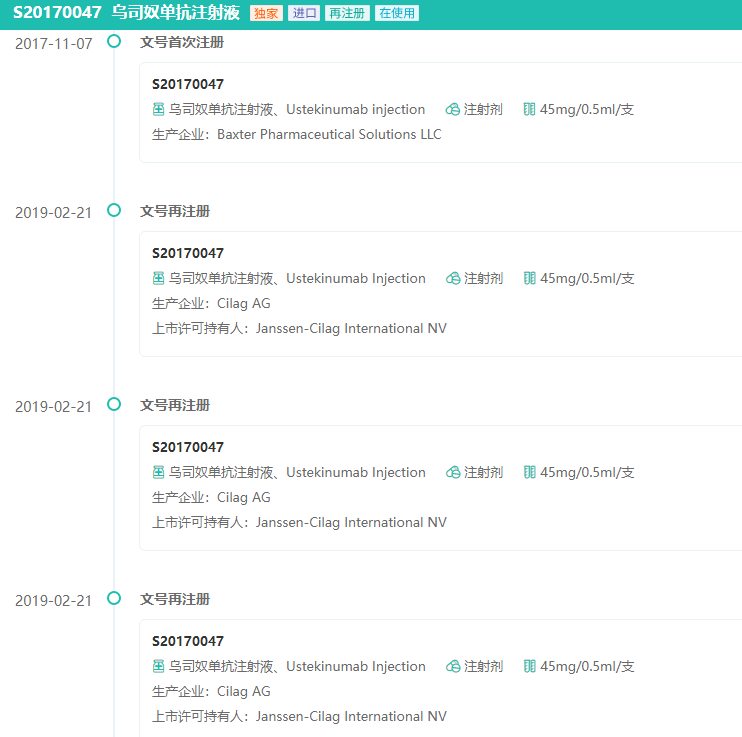
图片来源:药融云中国药品批文数据库
Stelara是强生销售额最高的药品之一,作为全球首个全人源“双靶向”IL-12和IL-23抑制剂,自推出后,安全良好的疗效和广大的市场需求赋予了其强劲的销售增速,远超同行业竞品,成为自免领域的重磅药物之一。2022年Stelara全球销售额为97.23亿美元,同比增长6.5%,逼近百亿美元大关。
截至目前,全球共布局24项乌司奴单抗生物类似物,已获批的有2款,分别是Alvotech Swiss AG的AVT-04,于2023年9月在日本获批;安进的Wezlana,于同年10月在美国获批。
此外,还有4款处于申请上市阶段,包括Formycon GmbH的FYB-202、DM Bio Ltd的DA-3115、韩国赛尔群的CT-P43、荃信生物的HDM-3001(QX001S);5款处于临床III期,3款处于临床I期,3款处于临床前阶段,1款药物发现阶段,其余品种状态为无进展或者研究终止。
乌司奴单抗生物类似物研发阶段
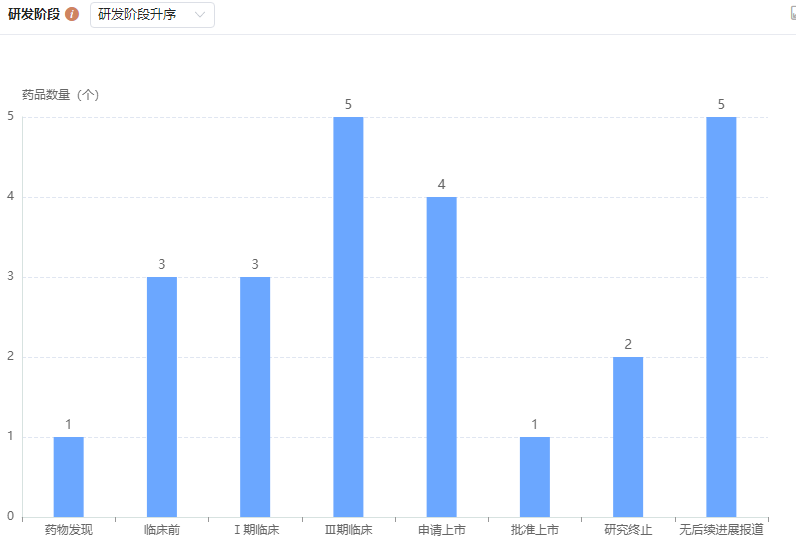
图片来源:药融云全球药物研发数据库
面对Stelara创下的百亿市场,国内药企也在摩拳擦掌。目前共有3家国内企业参与到乌司奴单抗生物类似物的竞争格局,分别为荃信生物与华东医药的QX001S(申请上市),百奥泰的BAT 2206(临床III期),石药集团的SYSA 1902(临床III期)。
此外,康方生物的AK101(ebdarokimab,依若奇单抗)同样是靶向IL-12/23 p40亚基的创新药,对标乌司奴单抗,国内银屑病适应症的上市申请已于今年8月23日获受理。
乌司奴单抗在自免疫领域具有重要地位,引领着自免疫领域二代生物制剂的发展。与传统的免疫抑制剂相比,乌司奴单抗具有更强的特异性和更高的安全性,因此成为了许多患者的首选药物,同时也为自免疫领域的研究和发展提供了新的方向和思路。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论