1.4.1 本周全球TOP10创新药研发进展
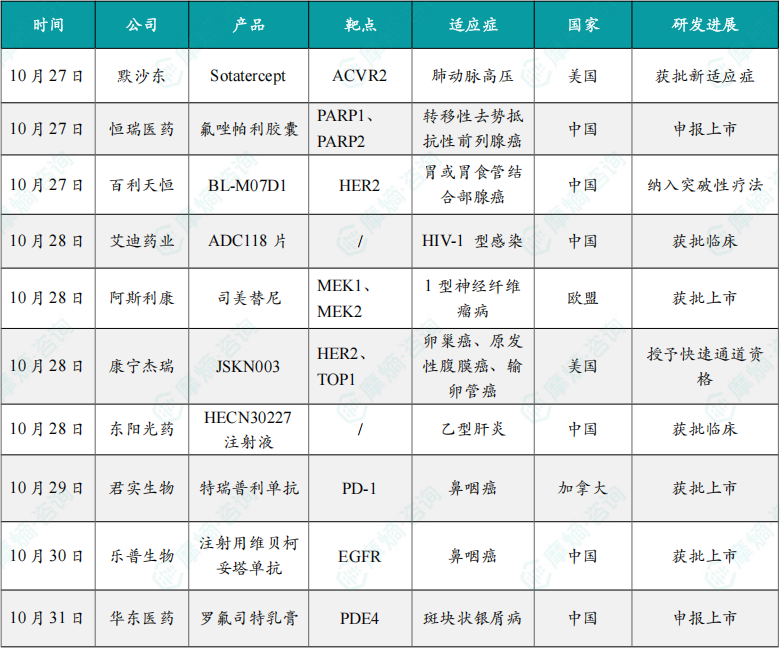
(1)默沙东肺动脉高压新药Sotatercept获FDA批准扩大适应症
10月27日,默沙东宣布 Sotatercept(Winrevair)的新适应症获FDA批准,用于治疗死亡风险高的WHO功能分级(FC)为III级或IV级的肺动脉高压(PAH)成人患者,以增强运动能力、改善WHO FC并降低临床恶化事件(包括死亡、肺移植和因PAH住院)的风险。
Sotatercept是一种ACVR2A-Fc融合蛋白 ,由人Activin受体IIA的胞外结构域与IgG1的Fc结构域融合而成。
2021年9月,默沙东以115亿美元的价格收购Acceleron Pharma,囊获Sotatercept。
2024年3月,该药物基于III期STELLAR研究的结果获FDA批准上市,用于治疗WHO FC为II级或III级的PAH成人患者,以增强运动能力、改善WHO FC并降低临床恶化事件的风险。
此次新适应症获批是基于III期ZENITH研究的积极结果。
(2)恒瑞医药氟唑帕利新适应症申报上市
10月27日,恒瑞发布公告,氟唑帕利胶囊的药品上市许可申请获国家药监局受理,联合阿比特龙和泼尼松或泼尼松龙用于DNA修复基因缺陷阳性(DRD+)的转移性去势抵抗性前列腺癌的一线治疗。
此前,该药已有4个适应症获批上市。2025年7月,氟唑帕利联合阿比特龙和泼尼松(AA-P)一线治疗转移性去势抵抗性前列腺癌的Ⅲ期临床试验(SHR3162-Ⅲ-305)主要研究终点结果达到方案预设的优效标准。结果显示,与安慰剂联合 AA-P 组相比,氟唑帕利联合AA-P 组的影像学无进展生存期取得了显著且有临床意义的改善。
(3)百利天恒HER2 ADC药物BL-M07D1拟纳入突破性治疗,针对胃癌
10月27日,根据CDE官网,百利天恒的HER2 ADC药物 BL-M07D1(T-Bren)拟纳入突破性疗法,用于既往经一线抗HER2治疗及一线标准化疗方案治疗失败的HER2阳性局部晚期或转移性胃或胃食管结合部腺癌(GC/GEJ)患者的治疗。
BL-M07D1是一款具有潜在同类最佳(BIC)潜力的HER2 ADC,在ESMO大会期间,百利天恒首次公布了BL-M07D1在既往经治的HER2阳性晚期GC/GEJ患者中的初步疗效和安全性。
结果显示,在HER2阳性三线及以上晚期胃癌患者(N=35)中,ORR为57.1%;DCR为94.3%;mPFS为10.2个月,6月PFS率为74.4%;9月OS率71.8%,1年OS率为67.3%。在HER2阳性二线晚期胃癌患者(N=31)中,ORR 58.1%;DCR为90.3%;mPFS为8.4个月,6月PFS率为61.8%;9月OS率为81.5%,1年OS率达61.2%。
(4)艾迪药业抗HIV复方制剂1类新药ADC118片获批临床
10月28日,中国国家药监局药品审评中心官网显示,艾迪药业自主研发的抗HIV领域1类新药 ADC118片 获批临床,适用于作为完整方案治疗人类免疫缺陷病毒1型(HIV-1)感染的成人。这是一款HIV整合酶抑制剂复方制剂。
ADC118片是艾迪药业以其全新化学结构的HIV整合酶抑制剂Asuptegravir(ASU,项目代号:ACC017)为核心,联合恩曲他滨、丙酚替诺福韦组成的三联复方制剂(ACC017/FTC/TAF),为化学1类新药。其可通过抑制HIV整合酶活性,有效阻断HIV基因组整合进入宿主基因组DNA。对于需要长期接受治疗的HIV患者来说,复方制剂可以大大简化用药流程,显著提高用药依从性。
(5)阿斯利康的司美替尼获欧盟批准上市
10月28日,阿斯利康罕见病部门Alexion宣布,口服、选择性MEK抑制剂 Koselugo (司美替尼) 已在欧盟获得批准,用于治疗伴有症状性、不可手术切除的丛状神经纤维瘤(PN)的1型神经纤维瘤病(NF1)成人患者。
这一批准是基于KOMET全球III期临床试验的结果,该试验显示肿瘤大小客观缓解率(ORR)达到了20%。Koselugo已获得了欧盟委员会的批准,此前欧盟人用医药产品委员会(CHMP)给出了积极意见。
此次获批将Koselugo改变生命的潜力扩展到了该地区的成人NF1 PN患者,保障了护理延续至成年期。
Koselugo作为一种激酶抑制剂,通过阻断MEK1和MEK2这两种参与细胞生长的特定酶来发挥作用。在NF1中,这些酶过度活跃,导致肿瘤细胞不受调控地生长,形成PN;通过阻断这些酶,Koselugo能减缓肿瘤细胞的生长,从而减缓PN的生长。
(6)康宁杰瑞铂耐药卵巢癌新药JSKN003获美国FDA快速通道资格
10月28日,康宁杰瑞宣布,公司自主研发的HER2双特异性抗体偶联药物(ADC)JSKN003,已获得美国FDA授予快速通道资格(FTD),用于治疗不限HER2表达水平的晚期或转移性铂耐药复发性上皮性卵巢癌、原发性腹膜癌或输卵管癌(PROC)。
这是JSKN003继今年分别在PROC和结直肠癌适应症上获中国NMPA纳入突破性治疗品种,及在胃癌/胃食管结合部癌上获FDA孤儿药资格后,再次获得国际权威监管机构的加速审评认可。
目前,JSKN003正在中国开展治疗铂耐药卵巢癌的3期临床研究,并在美国获准开展2期临床研究。此次获得FDA快速通道资格,将进一步推动JSKN003的临床开发与审评进程,为全球面临治疗困境的铂耐药卵巢癌患者带来新的希望。
(7)东阳光药自研乙肝小核酸新药HECN30227注射液国内获批临床
10月28日,国家药品监督管理局药品审评中心公开信息显示,东阳光药自主研发的siRNA疗法——HECN30227注射液已获临床试验默示许可,批准开展慢性乙型肝炎适应症的临床试验。
目前全球尚无乙肝siRNA药物获批上市。慢性乙肝是严重的全球公共卫生问题,我国患者基数庞大,约有7500万例慢性乙肝病毒(HBV)感染者,疾病负担沉重。
HECN30227是东阳光药自主研发并拥有全球知识产权的1类新药,也是公司基于小核酸技术平台开发的首款siRNA药物,可同时消除cccDNA和intDNA来源的乙肝表面抗原(HBsAg)。
临床前数据表明,HECN30227具有泛基因型活性,可高效降低HBsAg水平,对核苷类药物耐药株同样保持突出药效,体内外药效亦优于临床竞品。
(8)君实生物的特瑞普利单抗在加拿大正式获批
10月29日,君实生物宣布,PD-1抑制剂特瑞普利单抗已经在加拿大正式获批,成为该市场首个且唯一获批用于鼻咽癌的肿瘤免疫治疗。
特瑞普利单抗注射液(拓益®)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。目前,特瑞普利单抗已经在全球四大洲40+个国家和地区获批上市,包括美国、欧盟、印度、英国、约旦、澳大利亚、新加坡、阿联酋、科威特、巴基斯坦、加拿大等。
特瑞普利单抗至今已在全球(包括中国、美国、欧洲及东南亚等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。截至目前,特瑞普利单抗已在中国内地获批12项适应症。
(9)乐普生物EGFR ADC注射用维贝柯妥塔单抗获批上市
10月30日,国家药品监督管理局(NMPA)官网显示,乐普生物的注射用维贝柯妥塔单抗(MRG003)获批上市,用于治疗既往经至少二线系统化疗和PD-1/PD-L1抑制剂治疗失败的复发或转移性鼻咽癌(R/M NPC)患者。
维贝柯妥塔单抗是全球首个获批上市的EGFR ADC,该药由EGFR人源化单抗与强效的微管抑制有效载荷——甲基澳瑞他汀E(MMAE)通过缬氨酸-瓜氨酸链接体偶联而成,可以高亲和力特异性结合肿瘤细胞表面的EGFR,通过内吞及溶酶体蛋白酶裂解后释放强效的有效载荷,从而导致肿瘤细胞死亡。
作为我国首款靶向EGFR的ADC药物,维贝柯妥塔单抗凭借其高亲和力的EGFR抗体、可裂解的VC连接子与强效毒素MMAE的创新结构设计,为R/M NPC患者的后线治疗带来了全新选择。
(10)华东医药引进的罗氟司特乳膏在华申报上市
10月31日,CDE网站显示,华东医药引进的罗氟司特乳膏在华申报上市,用于治疗斑块状银屑病。
罗氟司特乳膏是Arcutis Biotherapeutics开发的一款创新外用制剂,包含磷酸二酯酶-4(PDE4)抑制剂罗氟司特,可通过抑制PDE4减少促炎介质的生成,从而减轻炎症反应。
2022年7月,0.3%罗氟司特乳膏在美国获批上市,商品名为ZORYVE。2023年8月,华东医药旗下全资子公司中美华东与Arcutis Biotherapeutics达成战略合作协议,以9425万美元的总交易额获得该产品在大中华区(含中国大陆、香港、澳门、台湾)及东南亚(印度尼西亚、新加坡、菲律宾、泰国、缅甸、文莱、柬埔寨、老挝、马来西亚、越南)的独家开发、注册、生产及商业化权益。
1.4.2 本周全球TOP10积极/失败临床结果
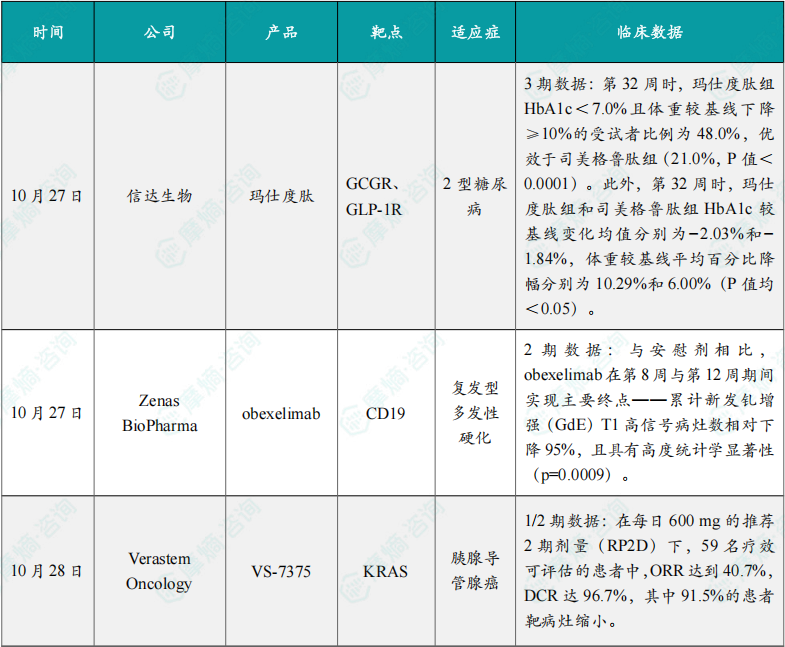
(1)信达生物玛仕度肽在3期临床试验中头对头击败司美格鲁肽
10月27日,信达生物宣布玛仕度肽(GCG/GLP-1双受体激动剂)的第四项III期临床研究(DREAMS-3)达到主要终点。
DREAMS-3(NCT06184568)是一项多中心、随机、开放标签III期临床研究,入组经单纯饮食运动干预伴/不伴二甲双胍单药治疗血糖、体重控制不佳的中国早期2型糖尿病(病程<10年)合并肥胖受试者349例。研究结果证明,在中国2型糖尿病合并肥胖受试者中,第32周时,玛仕度肽组HbA1c<7.0%且体重较基线下降≥10%的受试者比例为48.0%,优效于司美格鲁肽组(21.0%,P值<0.0001)。此外,第32周时,玛仕度肽组和司美格鲁肽组HbA1c较基线变化均值分别为−2.03%和−1.84%,体重较基线平均百分比降幅分别为10.29%和6.00%(P值均<0.05)。
研究期间玛仕度肽整体安全性特征与既往临床研究一致,未发现新增安全性信号。
(2)Zenas公布CD19抗体治疗多发性硬化症2期临床积极结果
10月27日,Zenas BioPharma宣布,双功能单克隆抗体obexelimab在复发型多发性硬化(RMS)患者开展的MoonStone临床2期试验中取得积极结果。与安慰剂相比,obexelimab在第8周与第12周期间实现主要终点——累计新发钆增强(GdE)T1高信号病灶数相对下降95%,且具有高度统计学显著性(p=0.0009)。
研究显示,obexelimab在治疗8周时即几乎完全抑制新的GdE T1高信号病灶形成,并持续至12周;经调整的每次扫描新发GdE T1高信号病灶数在obexelimab组为0.01(95% CI:0.00,0.06),安慰剂组为0.23(95% CI:0.11,0.51)。在治疗第8与第12周期间,该药还显著降低了累计新发和/或增大的T2加权高信号病灶数,提示可改善疾病负担或慢性病灶负荷。安全性方面与既往完成的试验一致,观察到感染和超敏反应个案,最常见为轻度注射部位反应。
(3)Verastem Oncology公司公布VS-7375 1/2期临床积极数据
10月28日,Verastem Oncology公司公布了口服KRAS G12D抑制剂 VS-7375 用于治疗KRAS G12D突变晚期胰腺导管腺癌的1/2期临床试验的积极数据。
VS-7375 由Verastem Oncology公司与劲方医药合作开发,是一款口服、高活性、高选择性小分子抑制剂,能够同时作用于KRAS G12D蛋白的活性态(ON)和非活性态(OFF,与GDP结合)。该分子通过非共价形式结合KRAS G12D蛋白,抑制其与下游效应蛋白结合,高效抑制肿瘤细胞增殖。
该研究共纳入了66名患者,其中95.5%为IV期,且多数(68.2%)已接受过至少两线的化疗方案。截至2025年9月27日的数据,在每日600 mg的推荐2期剂量(RP2D)下,59名疗效可评估的患者中,ORR达到40.7%,DCR达96.7%,其中91.5%的患者靶病灶缩小。观察到4个月时的总生存(OS)率为92.2%,中位总生存期尚未达到,中位无进展生存期(PFS)为5.52个月。安全性方面,治疗相关不良事件导致的停药率低至3%,表明 VS-7375 的安全性可控。
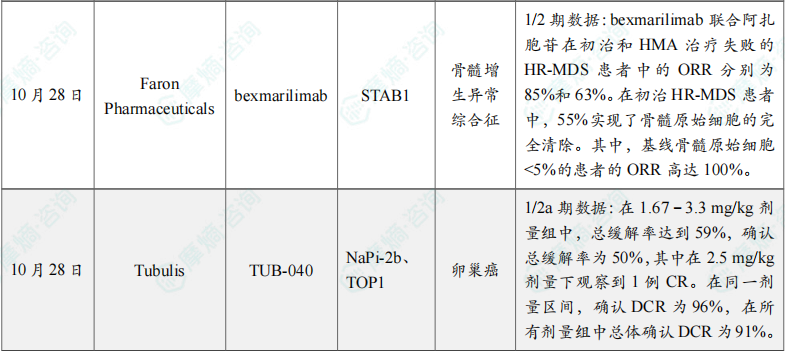
(4)Faron Pharmaceuticals公司公布bexmarilimab 1/2期临床积极数据
10月28日,Faron Pharmaceuticals公司宣布,其靶向Clever-1的单克隆抗体 bexmarilimab 的一项1/2期临床试验获得了积极结果。该研究旨在评估 bexmarilimab 联用 阿扎胞苷 治疗初治高危骨髓增生异常综合征和低甲基化剂(HMA)治疗失败的复发/难治性(r/r)HR-MDS患者的安全性和有效性。
Bexmarilimab 是Faron公司全资拥有的在研免疫疗法,旨在通过靶向髓系细胞功能和激活免疫系统,克服对现有疗法的耐药性并优化临床疗效。Bexmarilimab能与巨噬细胞上的免疫抑制受体Clever-1结合,该受体有助于肿瘤生长和转移(即帮助癌症躲避免疫系统)。通过靶向巨噬细胞上的Clever-1受体,bexmarilimab 可改变肿瘤微环境,将巨噬细胞从免疫抑制(M2)状态重编程为免疫刺激(M1)状态,上调干扰素的产生,启动免疫系统攻击肿瘤,使癌细胞对标准治疗敏感。
此次公布的结果显示,bexmarilimab 联合 阿扎胞苷 在初治和HMA治疗失败的HR-MDS患者中的ORR分别为85%和63%。在初治HR-MDS患者中,55%实现了骨髓原始细胞的完全清除。其中,基线骨髓原始细胞<5%的患者的ORR高达100%。HMA治疗失败的r/r MDS患者的中位总生存期为13.4个月。该研究中,23%的患者在治疗后接受了造血干细胞移植(HSCT)。
安全性方面,bexmarilimab 联合治疗的耐受性良好,其安全性与阿扎胞苷单药治疗相似,甚至更好。
(5)Tubulis公司公布TUB-040 1/2a期临床积极数据
10月28日,Tubulis公司公布了NAPISTAR1-01临床1/2a期研究的积极临床数据。该研究评估了公司主打抗体偶联药物 TUB-040 在铂类耐药的高级别浆液性卵巢癌患者中的疗效与安全性。
TUB-040 是一种靶向NaPi2b抗原的IgG1抗体,通过Tubulis的专有P5偶联技术连接拓扑异构酶I抑制剂exatecan,形成具有可切割连接子的ADC疗法,设计用于治疗高表达NaPi2b的卵巢癌和肺腺癌。
这次所公布的中期分析结果显示,TUB-040 已完成Tubulis专有Tubutecan平台的临床概念验证(PoC),并确认NaPi2b是一个具有潜力的新型ADC靶点。
分析显示,TUB-040 在未经过生物标志物筛选、曾接受过多线治疗的铂类耐药卵巢癌患者中展现出显著的抗肿瘤活性和良好的耐受性。在1.67–3.3 mg/kg剂量组中,总缓解率达到59%,确认总缓解率为50%,其中在2.5 mg/kg剂量下观察到1例CR。在同一剂量区间,确认DCR为96%,在所有剂量组中总体确认DCR为91%。其中3.3 mg/kg组的疗效数据仍在持续成熟中。此外,81%的患者在治疗过程中展现CA-125应答。TUB-040 在所有剂量水平下总体耐受性良好,大多数治疗伴发不良事件为1级或2级。
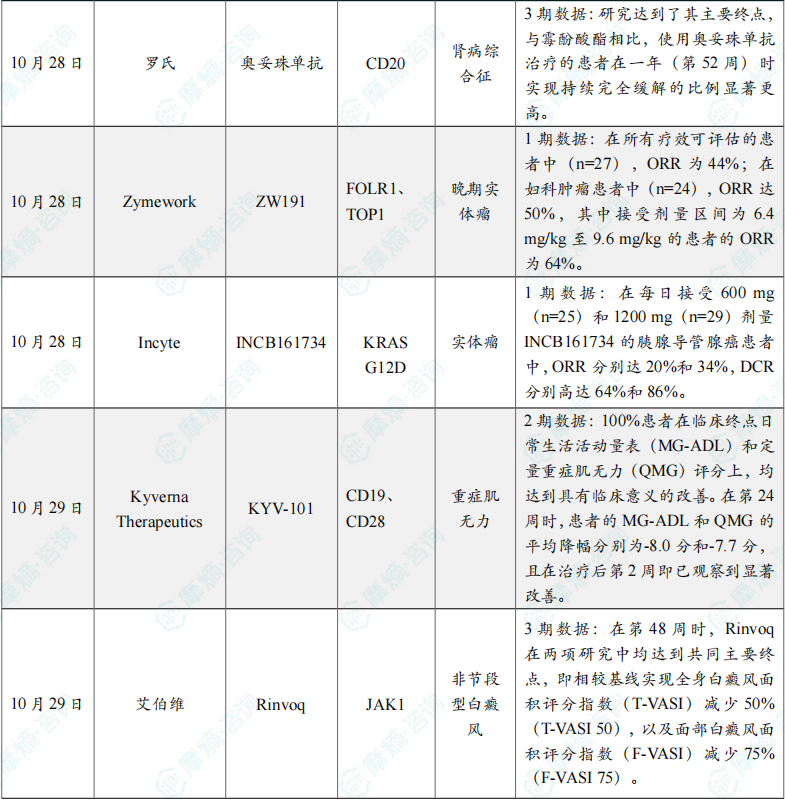
(6)罗氏的奥妥珠单抗临床3期研究成功,治疗特发性肾病
10月28日,罗氏宣布其Gazyva®/Gazyvaro®(奥妥珠单抗,obinutuzumab)在治疗患有特发性肾病综合征的儿童和青少年(年龄在2至25岁)的III期INShore研究中取得了具有统计学意义和临床意义的积极结果。
这项研究达到了其主要终点,与霉酚酸酯相比,使用奥妥珠单抗治疗的患者在一年(第52周)时实现持续完全缓解的比例显著更高。持续完全缓解的定义是研究期间没有复发,并且在第52周时尿液中的蛋白质含量较低(蛋白质与肌酐比值低于或等于0.2)。
INShore研究是针对这种通常在儿童早期诊断的慢性肾脏疾病的靶向疗法,进行的首次全球性III期研究。研究中没有发现新的安全信号,且安全性与Gazyva/Gazyvaro在成人中的已知特征一致。相关数据将提交美国FDA和欧洲药品管理局(EMA),并将在即将召开的医学会议上公布。
(7)Zymeworks公司公布ZW191 1期临床初步结果
10月28日,Zymeworks公司公布了其ADC疗法 ZW191 治疗晚期实体瘤的1期临床试验的初步结果。
ZW191靶向叶酸受体α(FRα),该靶点在约75%的高级别浆液性卵巢癌和约70%的肺腺癌中表达。
ZW191具有独特的设计,可高效进入FRα阳性细胞,并释放Zymeworks开发的具旁观者效应的载荷——拓扑异构酶I抑制剂ZD06519。
截至2025年9月10日的数据,ZW191在铂类耐药卵巢癌、转移性子宫内膜癌和转移性非小细胞肺癌患者中展现出良好的初步疗效和安全性。在所有疗效可评估的患者中(n=27),ORR为44%;在妇科肿瘤患者中(n=24),ORR达50%,其中接受剂量区间为6.4 mg/kg至9.6 mg/kg的患者的ORR为64%。在≥3.2 mg/kg的剂量组中均观察到ZW191的疗效,且不限于高FRα表达的肿瘤。
安全性方面,ZW191表现出可控的安全性,剂量调整/延迟率低。
(8)Incyte公司公布INCB161734 1期临床积极数据
10月28日,Incyte公司公布了其候选药物 INCB161734 用于治疗携带KRAS G12D突变的晚期或转移性实体瘤的1期临床试验的积极数据。
INCB161734 是一款高选择性靶向KRAS G12D突变的口服小分子药物,其可以皮摩尔级亲和力同时结合KRAS G12D的ON和OFF两种状态,相较于野生型KRAS展现出超过80倍的选择性。
临床前研究显示,该药物具备优异的口服生物利用度。口服给药后,INCB161734 能够实现持续的高水平靶点占有率,在KRAS G12D突变胰腺癌小鼠模型中几乎可维持整个给药间隔的接近最大程度的抑制效果。
截至2025年8月1日的数据,在所有接受治疗的患者中都表现出可控的安全性。在每日接受600 mg(n=25)和1200 mg(n=29)剂量INCB161734的胰腺导管腺癌患者中,ORR分别达20%和34%,DCR分别高达64%和86%。
(9)Kyverna Therapeutics公司CAR-T疗法自免适应症临床2期临床结果积极
10月29日,Kyverna Therapeutics宣布,其注册性2/3期临床试验KYSA-6中,CAR-T疗法 KYV-101 用于治疗全身性重症肌无力(gMG)在2期试验阶段取得积极中期数据。
100%患者在临床终点日常生活活动量表(MG-ADL)和定量重症肌无力(QMG)评分上,均达到具有临床意义的改善。在第24周时,患者的MG-ADL和QMG的平均降幅分别为-8.0分和-7.7分,且在治疗后第2周即已观察到显著改善。此外,100%(6/6)患者在MGC方面达到具有临床意义的缓解,24周平均改善-12分。KYV-101在单次给药后可显著降低治疗负担,至24周时,100%患者已无需使用非甾体免疫抑制剂、高剂量糖皮质激素(>10 mg),以及FcRn抑制剂或补体抑制剂。Kyverna预定在今年年底前启动3期试验部分的患者入组。
(10)艾伯维口服JAK抑制剂临床3期试验成功,针对非节段型白癜风
10月29日,艾伯维宣布,其口服JAK抑制剂 Rinvoq(upadacitinib)在两项针对成人及青少年非节段型白癜风(NSV)患者的3期重复研究中取得积极顶线结果。这两项研究旨在评估 Rinvoq 在改善皮损面积和面部脱色程度方面的疗效及安全性。
Rinvoq 由艾伯维的科学家发现并开发,是一种用于治疗多种免疫介导的炎症性疾病的JAK抑制剂。基于酶学和细胞分析,Rinvoq对JAK1的抑制效力大于JAK2、JAK3和TYK2。
研究结果显示,在第48周时,Rinvoq 在两项研究中均达到共同主要终点,即相较基线实现全身白癜风面积评分指数(T-VASI)减少50%(T-VASI 50),以及面部白癜风面积评分指数(F-VASI)减少75%(F-VASI 75)。
此外,两项研究还达成了关键的次要终点,进一步支持了该药物在恢复皮肤色素方面的潜在临床价值。
同期事件:
1. 2025年第44周10.27-11.02国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第44周10.27-11.02国内仿制药/生物类似物申报/审批数据分析
3. 2025年第44周10.27-11.02国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.10.27-2025.11.02) },如需查看或下载完整版报告,可点击!
扩展阅读:
1. 2024年第39-40周09.23-10.06全球创新药研发概览
2. 2024年第41周10.07-10.13全球创新药研发概览
3. 2024年第44周10.28-11.03全球创新药研发概览
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
























































 川公网安备51019002008863号
川公网安备51019002008863号 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论